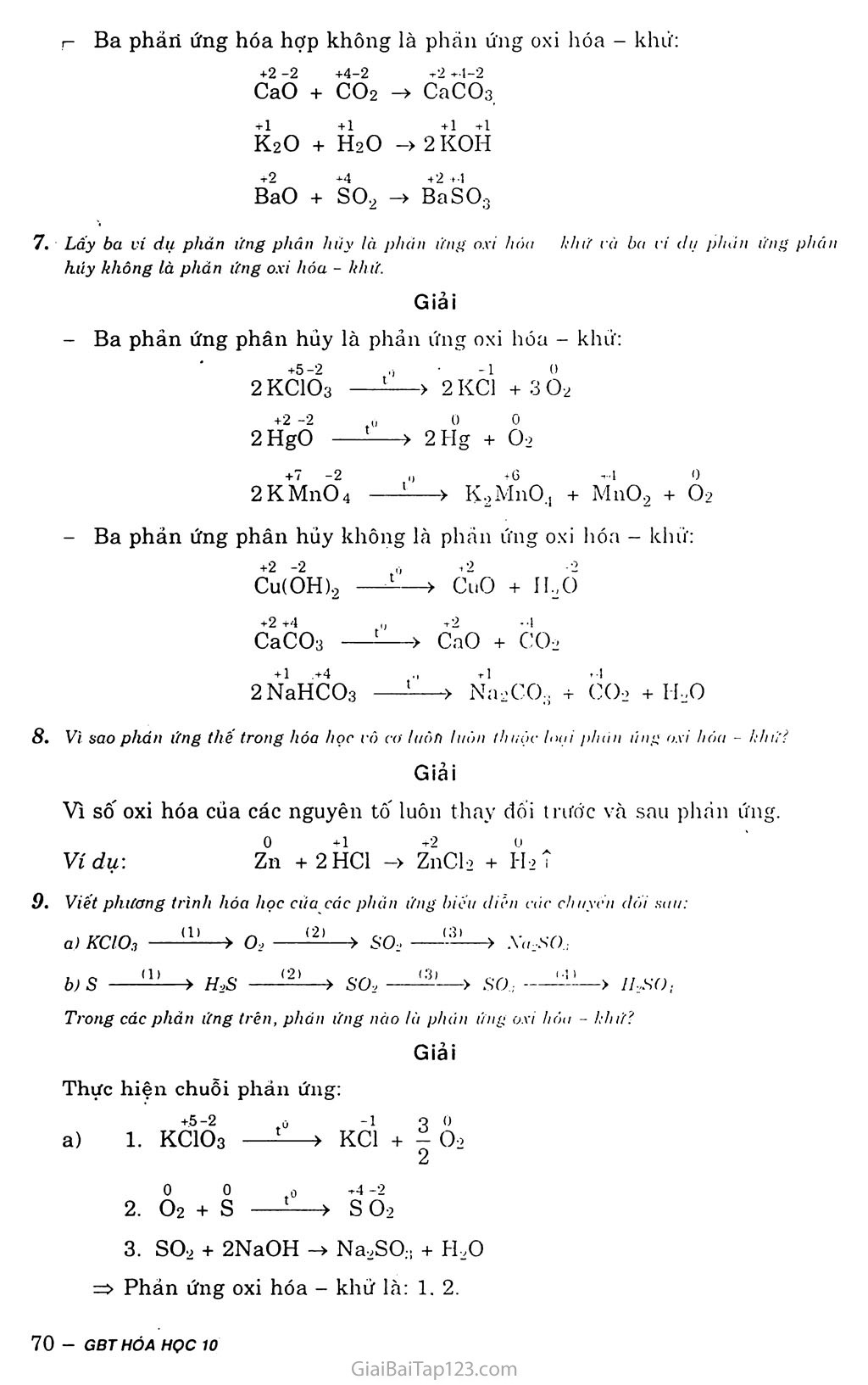Giải bài tập Hóa 10 Bài 18: Phân loại phản ứng trong hóa học vô cơ
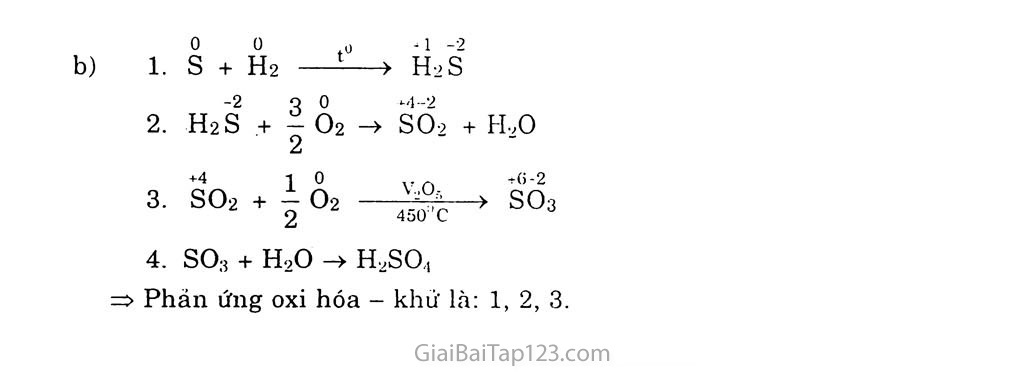
§18. PHÂN LOẠI PHẢN ỨNG TRONG HÓA HỌC vô cơ A. LÍ THUYẾT PHẢN ỨNG CÓ sự THAY Đổi số OXT HÓA VÀ PHẢN ÚNG KHÔNG CÓ Sự THAY Đổi số OXI HÓA Phản ứng hóa hợp Phản ứng hóa hợp là phản ứng hóa học, trong đó hai hay nhiều chất hóa hợp với nhau tạo thành một châ't mới. 0 0 + 1 -2 Ví dụ 1: 2 Ha + 0-2 —» 2HạO Sô' oxi hóa của hiđro tăng từ 0 đến +1: Sô' oxi hóa của oxi giảm từ 0 xuông -2. +2 -2 +4-2 +2 +4-2 Ví dụ 2: CaO + COa -> CaCOs Sô' oxi hóa của các nguyên tố không thay đổi. Nhận xét: Trong phản ứng hóa hợp, sỏ' oxi hóa của các nguyên tô' có thể thay đồi hoặc không thay đổi. Phản ứng phân hủy Phản ứng phân hủy là phản ứng hóa học, trong đó một chát bị phân hủy thành hai hay nhiều chất mới. Vídụl: 2KỎÌỔ3 -> 2KC1 + 30-2T Sô' oxi hóa cửa oxi tăng từ -2 đến 0; Sô' oxi hóa của clo giảm từ +5 xuông -1. +2-2+1 +2-2 -1 -2 Ví dụ 2: Cu(ÕH)2 -> Cuõ + Hạõ Sô' oxi hóa của các nguyên tô' không thay đổi. Nhận xét: Trong phản ứng phân húy, sô' oxi hóa của các nguyên tô' có thể thay đổi hoặc không thay đối. Phản ứng thê' Phản ứng thê' là phản ứng hóa học, trong đó nguyên tử của nguyên tố này ở dạng đơn chất thay thế nguyên tử của nguyên tô' khác trong hợp chất. Ví dụ-. Cu + 2 AgNOg -> CŨ(NO3)2 + 2 Agị Số oxi hóa của đồng tăng từ 0 lên +2; Sô' oxi hóa của bạc giảm từ +1 xuỏng 0. Nhận xét: Trong phán ứng thế, bao giờ cũng cọ sự thay đổi sõ' oxi hóa của các nguyên tố. 4. Phản ứng trao đồi Phản ứng trao đổi là phản ứng hóa học, trong đó các hợp chất trao đối nguyên tử hay nhóm nguyên tử VỚI nhau. + 1 +5 -2 +1-1 +1 -1 +1 +5 -2 Ví dụ'. AgNƠ3 + NaCl -> AgCl1+ NaNƠ3 Số oxi hóa của tất cả các nguyên tố không thay dổi. Nhận xét: Trong phản ứng trao đôi, số oxi hóa của các nguyên tố không thay đổi. II. KẾT LUẬN Dựa vào sự thay đổi số oxi hóa, có thể chia phản ứng hóa học thành hai loại: Phản ứng hóa học có sự thay đổi số oxi hóa, tức lả phán ứng oxi hóa - khử. Phản ứng hóa học không có sự thay đối sô' oxỉ hóa, tức là phan ứng không oxi hóa - khử. B. BÀI TẬP 1. Cho phản ứng: 2Na + CK ->2ÌVaCl. Trong phán ứng này, nguyên tử natri. A. BỊ oxi hóa. c. Vừa bị oxi hóa, vừa bị khử. Chọn đáp an dùng. B. Bị lihử. D. Không bị oxi hóa. không bị khứ. Giải 0 +1 Na -> Na + le: quá trình oxi hóa Na là chát khứ hay chất bị oxi hóa. Đáp án A 2. Cho phản ứng: Zn + CuCl-2 ->ZnCl> + Cu. Trong pliăn ứng này, 1 mot ion Cu2'. A. Đà nhận 1 mol electron, c. Đã nhường 1 mol electron. Chọn đáp án dùng. B. Dà nhạn 2 /noi electron. D. Dà nhường 2 mol electron'. 2e Giải Zn + CuGL -> ZnCỤ + Cu => Cu2+ đã nhận 2 mol electron từ Zn. Đáp án B Cho các phán ứng sau: .4. Al,C3 + 12H20 -> 4AK0H):, + 3CH, B. 2N(I + 211,0 -> 2NaOặ + ỉỉ2 c. NaH + HịỌ NaOH + Hi D. 2F-, + 2IỈ2O -> 4IIF + 0, Phản ứng nào không là phản ứng oxi hóa - hhử? Giải ẤỈ4C3 + 12H,0 -> 4AKOH)34 + 3CH.J Ta thấy số oxi hóa của các nguyên tố trong các hợp chất không đổi nên không là phản ứng oxi hóa - khử. Đáp án A Dâu hiặu đế nhận biét một phản ứng oxi hóa khử'? Tạo ra chắt kết tủa. Tạo ra chất khí. c. Có sự thay đối lìiàtt sac cua các chất. D. Có sự thay đối sô oxi hóa cùa một hay một số nguyên tô. Chọn đáp án đúng. Đáp án D Trong nhưng phán ứng sau đây. phán ứng nào !à phán ứng OXI hóa - khu? Gi(ii thích. so3 + H .0 -FH2SO, CaCOn + 2HCI -> CaCl-Ị + co, + fỉ2O C + H,0 —> CO + H-, co2 + CatOH), -> CaCO3 + H2O Ca + 2H,0 CatOHỉí + H-, g) 2KMnO, - > K2MnO.Ị + MnO, + 02. Giải Các phản ứng oxi hóa - khử là: c, e, g. g)2KMnO4 —> K2MnO., + MnO2 + Ỏ2 Lấy ba vi dụ phán ứng lióa hợp là p/iìm ứng oxi hóa - khú' và ba vi dll phản ứng hóa hợp không lờ phản ứng oxi hóa - khứ. Giải - Ba phản ứng hóa hợp là phàn ứng oxi hóa - khứ: 0 0 +3 -1 2Fe + 3C12 -> 2 FeCls +2 0 -3 4Fe(OH)2 + Ỏ2 + 2HọO -> 4Fe(OH)g 0 0 +1-1 Ẽ2 + CI2 -> 21-ĨCĨ r Ba phảri ứng hóa hợp không là phán ứng oxi hóa - khứ: +2 -2 Caõ +4-2 + CỠ2 +2 +4-2 -> cãcõs +1 +1 +1 +1 K2O + H2O -> 2 K0H +2 +4 +2 +4 Bão + SO2 —> BaSOg Lấy ba vi dụ phản ứng phân hiíy là phàn ứng oxi hán - lìhit và ba vi dụ phàn ứng phán hủy không là phán ứng oxi hóa - khử. Giải Ba phản ứng phân hủy là phản ứng oxi hóa - khử: +5-2 .,) • -1 0 2KC1Ỡ3 —> 2KC1 +3 0-2 +2 —2 0 0 0 2HgO ——> 2Hg + 0-2 2KM11O4 > KọMnO.ị + M11O9 + O2 Ba phản ứng phân hủy không hà phán ứng oxi hóa - khử: +2 -2 ,0 ±2 _ -2 Cu(ÕH)2 —> CuO + ILC) +2 +4 0 2 2 CaCOs ——-> căo + CO2 2NaHCO3 —> Na+COg + co2 + IhO Vi sao phán ứng thế trong hóa học vô co li/òn luân thuộc loai phún ling oxi hóa - khứ! Giải Vì sô' oxi hóa của các nguyên tố luôn thay đổi trước và sau phan ứng. Ví dụ-. Zn +2HC1 -> ZnCl-2 + H ’i Viết phương trình hóa học của các phan ứng biếu diễn các chuyên dõi sau: KCIO3 ——> 02 ——> so. ——> AVz-SQ; s — > H-.S — > so, — > SO; — -> Trong các phản ứng trên, phún ứng nào là phán ứng oxi hóa - khứ? Giải Thực hiện chuỗi phản ứng: +5-2 0 -1 3 0 1. KClÕs —-> KC1 + 4 O2 2 0 0 ,0 +4 -2 Ỏ2 + S L—> s Ỡ2 so2 + 2NaOH -> Na2SO;! + H+0 => Phán ứng oxi hóa - khử là: 1. 2. ọ 0 t0 +1-2 1. s + IỈ2 í—> Ẽ2S -2 9 0 +4-2 2. H2S + I Ỏ2 -> SÕ2 + H,0 2 +4 1 0 vr +6-2 3- s°2 + i °2 —> s°3 so3 + H2O -> H,so„ => Phản ứng oxi hóa - khử là: 1, 2, 3.