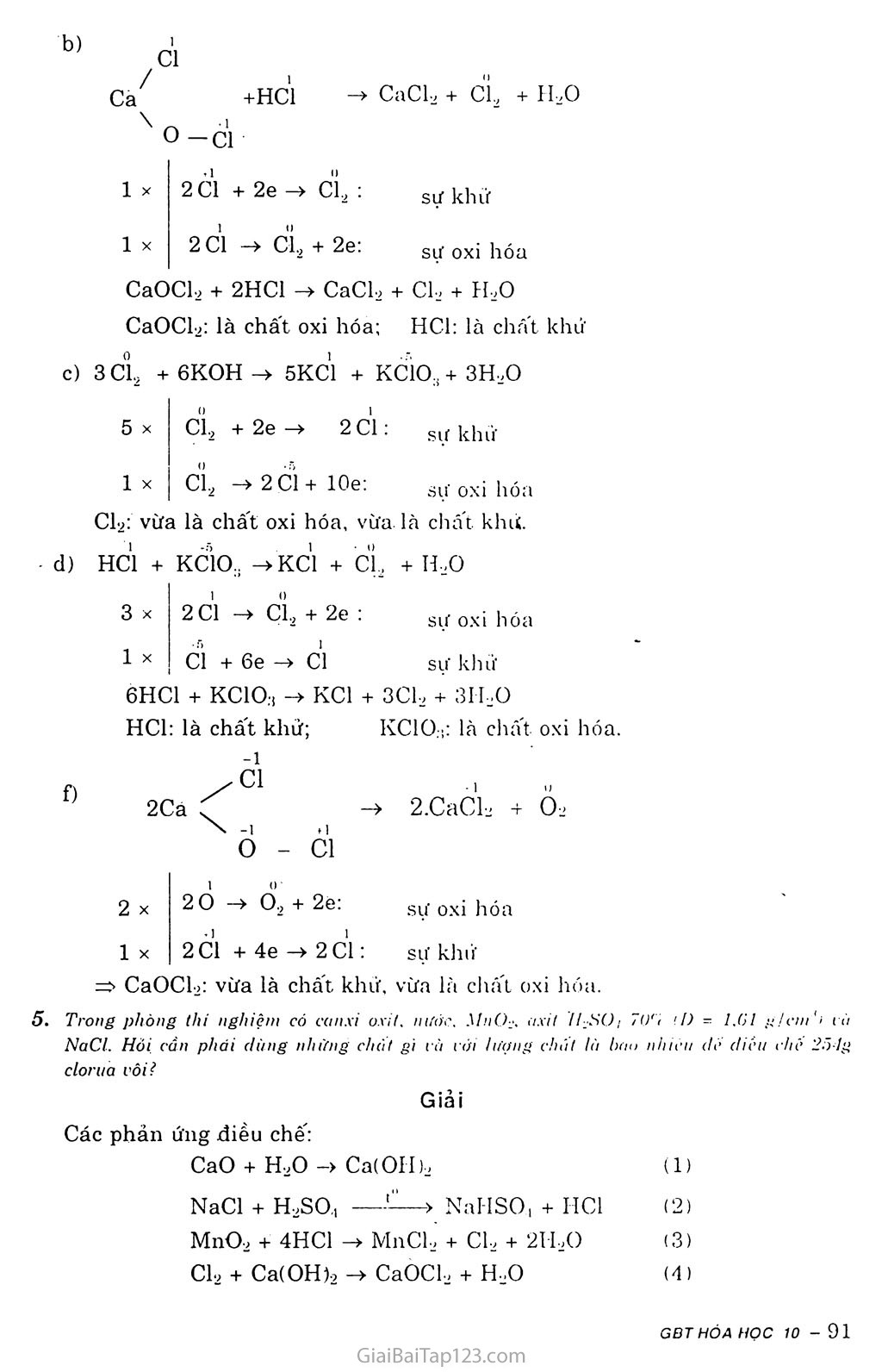Giải bài tập Hóa 10 Bài 24: Sơ lược về hợp chất có oxi của clo
§24. Sơ LƯỢC VẾ HỌ’P CHẤT có OXI CỬA CLO
I. NƯỚC GIA-VEN
Nước Gia-ven là dung dịch hỗn hợp muôi NaCI và NaClO (nat.rihipoclorit). Muôi NaClO có tính oxi hóa rất mạnh, do vậv nước Gia-ven có tính tẩy màu và sát trùng, dùng đế’ tẩy trắng vái, sợi, giây và dùng dế rẩy uế chuồng trại, nhà vệ sinh.
NaClO là muôi của axit yêu (yếu hơn axit cacbonic), trong không khi 11Ó tác dụng dần dần với co2 tạo ra axit hipoclorơ HC1O không bền, có tính oxi hóa rất mạnh:
NaClO + CO, + H,0 -> NalICOã + HC1O Trong phòng thi nghiệm, nước Gia-ven. (Javen) được điều chế bằng cách cho khí clo tác dụng với dung dịch NaOH loãng ỏ' nhiệt độ thường:
Cl2 + 2NaOH -> NaCl + NaClO + H,0 (Nước Gia-ven)
Trong cóng nghiệp, nước Gia-ven được sản xuất bằng cách điện phân dung dịch muôi ăn (nồng độ từ' 15 - 20%) trong thùng diện phán không có màng ngăn.
2NaCl + 2H,0 -> 2NaOH + H,T + C1,T (catôí) t.anôt)
Do không có màng ngăn nên C1, thoát ra ở iìiiôt tác dụng với NaOH (cũng vừa được tạo ra) ở catỏt. trong dung dịch tạo ra nước Gia-ven.
Cl, + 2NaOH -> NaCl + NaClO + 11,0
II. CLORUA VÔI
Clorua vôi là chất bột màu trắng xốp.
Thành phần chính cùa clorua vôi là CaOCl, có công thức câu tạo:
-1
Ca
4.1
C1
'C1
o-
Như vậy, clorưa vôi là muôi cùa kim loại (canxi) với hai loại gốc axit là clorua Cl“ và hipoclorit C10‘. Muôi cùa một. kim loại vời nhiều loại gôc axit khác nhau được gọi là muôi hồn tạp.
Trong không khí, clorua vôi tác dụng dần dan với co, và hơi nước giái phóng hipoclorơ HC1O:
2CaOCl, + co, + H,0 -> CaCO;, + CaCl, + 2IIC1O Clorua vôi có tính oxi hóa mạnh tương tự nước Gia-ven nõn dược dùng đè tay trắng vải, sợi, giấy. So vói nước Gia-ven, clorua vôi rỏ hơn. hàm lượng hipoclorit cao hơn nên còn dùng tẩy uế hố rác, cống rãnh, chuồng trại chân nuôi....
Một lượng lớn clorua vôi được dùng trong việc tinh ché dầu mỏ.
Khi cho khí clo tác dụng với vôi tói hoặc sữa vôi. ơ 30"C ta thu dược clorua vói:
Cl, + Ca(OH), -> CaOCl, + H,0
B. BÀI TẬP
1. c.họn câu đúng trong các câu sau:
. Clorua ròi là muôi tạo búi một him loại liên hét l ới một loại gãc axil.
Clorua vôi là muối tạo bới một him loại liên hét với bai loại gõc axil,
c. Clorua vói là muôi tạo bởi bai him loại liên hét vói IIIỘI loại gôc axit.
D. Clorua vôi không phủi là muôi.
Đáp án B
2. Nèu tilth chát hỏa học chinh cà ứng dưng ctiti nước (ùta-crn. clơran cài.
Giải
Tính chất hóa học chính của nước Gia-ven và clorua vôi là tính oxi hóa
■ 1 +1 mạnh cúa hipoclorit ( NaClO ) cụ thè là muói na! ri. tính oxi hóa của C1. Chú ý: không nên giai thích là các chát trẽn không bền, (lè phán húy tạo thành oxi nguyên tử và oxi nguyên tu’ có tính oxi hóa mạnh hà nguyên nhân tính oxi hóa mạnh cùa IIC1O và NaClO.
Ưng dụng của nước Gia-ven:
Dùng để sát trùng, tây tráng sựi. 'vai, giây,...
Dùng đê tầy uế chuồng trại, nhà vọ si nh,...
Ưng dụng cua clorua vôi: tương tự nhu' nứớc Gia-ven. ngoài ra clorua vôi dùng trong việc tinh chế dầu mỏ, xứ lí chat dộc, bao vệ mòi trường,...
3. Trong phòng thi nghiệm có các hóa chãi: XaCI. ìlntl... .\'at)Ị! Cu dục. ta <•<; the (Ill'll,
chè dược nước Gìu-cen hhõngt Viet phương truth háa hục ’ I.a phtin ứng.
Giải
Điều chê axit. HC1 từ NaCl, IỰSO| dặc, ]ỰO:
NaCl + H,so, --—> NalĩSG, + 1ICI?
Hấp thụ khi hiđro clorua vào nước được đung dịch axil HOI.
Từ HC1 và MnOọ diều chè cự:
MiiOị + 4HC1 —> MnCh. + cự + 21ỰO
' Từ CƯ và dung dịch NaOH điều chế nước Gia-ven:
CƯ + 2NaOH NaCl + NaCỈO r I-ỰO
Cá những sa dồ phán ứng hóa học san: at Cì; + H.O ,
Ht. 7 1- //(-:o
b.t CaOCl-. + Hd y
Cad ■ + C7, r n..()
c) CI-, + KOH I" ,
Kd X IICIO;; - 11/1
d) HCI + KCIO, y
KCI + Cl- -r II 0
e> NciCAO + co, + H,o )
XallCO + IICIO
f) CnOCl ’ )
CaCI, + o.
Cho biết những phán ứng nào lít phàn ừng oxi hóa-khư lú cat trà các chát tham gia phán ứng oxi hóa-khiỉ. Hoán thánh phương trinh hóa học cứa phán ứng.
Giải
Các phàn ứng oxi hóa-khử là: a. b, c, d. f.
a) ci, + H2O -> HCÌ + Hcìo
ọ -1
X C1, + 2e —> 2 C1: sự b[Uf
lx Cl2 —>2Cl+2e: sự oxihóa
CƯ + H,0 -> HC1 + HC1O
CƯ: vừa là chất oxi hóa, vừa hà chát khứ.
b)
1
Cl
Ca
+HC1
CaCb + CL + H20
o — Cl
2 Cl + 2e -» CL : 2 ci -> CL + 2e:
sự khứ
sự oxi hóa CaOCl, + 2HC1 -> CaCl2 + CL- + H,0 CaOCh: là chất oxi hóa; HC1: là chat khứ c) 3 cĩ2 + 6KOH -» 5KC1 + KC1O., + 3H2O 5 X Cl9 + 2c —> 2 Cl; gif l^hii’
1 X Cl2 —> 2 Cl + lOe; gụ- oxi h(5a
Cl2: vừa là chat oxi hóa, vừa là chát. khií.
d) Hcì + KC1O.J ->KC1 + CL, + H2O
2 cì -> c'i2 + 2e : ci + 6e -> C1
sự oxi hóa
f)
sự khứ + 3LI2C KClO.i: là chát oxi hóa.
-> 2.CaCL + Ỏ2
6HC1 + KC1O.J -> KC1 + 3CL + 31LO HC1: là chất khử;
2Ca
cì
\ ->
0
+1
C1
sự oxi hóa sự khứ
0 -> 0., + 2é:
2 cì + 4e -> 2 cì ;
=> CaOCl2: vừa là chất khứ, vừa hà cliíít oxi hóa.
5. Trong phòng thi nghiệm cá canxi oxit. nước. MnOc. axil IbSOi 70'r !Í) - 1.61 g/cm'i lớ NaCI. Hỏi cần phái dùng những chòt gi vò vin lượng chát lù bím nhiên lie (lieu chẽ 2õ-lg
clorưa vôi?
Giải
(1)
(2)
(3)
(4)
Các phản ứng điều chế;
CaO + H20 -> Ca(OII)2 NaCl + H2SO, —> Nal-ỈSO, + HC1 MnO2 + 4HC1 -> MnCL + CL, + 2LL-0 Cl2 + Ca(OH)2 -> CaOCL + H20
rp .. „ _ 254
127
Từ (3) và (4) suy ra:
iK.nO, = 2 mol
Ta có: nca<x i., - = 2 (molJ
=> mM„02 = 2 X 87 = 174 (g)
Từ (2), (3) và (4) suy ra: nll K() = 8 moi; nNa(;i = 8 mol
=> mNaci = 8 X 58,5 = 468 (g); miụso4 = 8 X 98 = 784 (g).
Từ (1) và (4) suy ra: n('a0 = 2 mol => mcaO = 2 X 56 = 112 (g).