Giải bài tập Hóa 10 Bài 33: Axit sunfuric - Muối sunfat
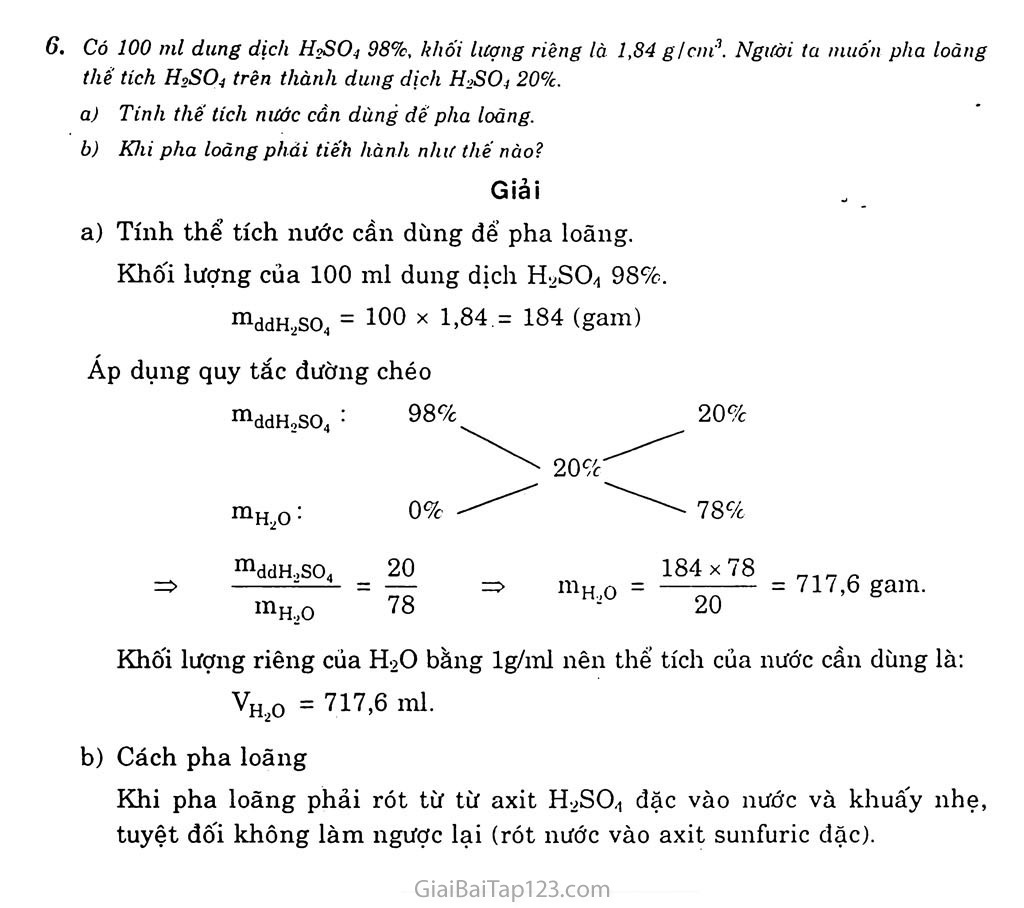
§33. AXIT SUNFURIC H2SO4, MUOI SUNFAT A. LÍ THUYẾT I. AXIT SUNFURIC Tính chat vật lí Axit H2SO,] là chất lỏng sánh như dầu, không màu, không bay hơi, nặng gần gấp 2 lần nước (H2SO., 98% có D = 1,84 g/cm’’). H2SO4 tan vô hạn trong nước và tòa rảt nhiều nhiệt. Muôn pha loãng axit HọSCb đặc. người ta phải rót từ từ axit .vào nước và khuây nhẹ bằng đũa thủy tinh mà không được làm ngược lại. Tính chất hóa học Tính chất-dung dịch của axit sunfuric loãng: Dung dịch axitsunfuric loãng có những tính chát chung cùa axit, dó là: Đổi màu quỳ tím thành đỏ. Tác dụng với kimToại hoạt động, giái phóng khí hiđro. Ví dụ: Fe + H9SO4 —> FeSCh + H2T Tác dụng với oxit bazơ và với bazơ Ví dụ: ZnO + H9SO4 —> ZnSO4 + H2O Cu(OH)2 + H2SO., -> CuSO, + 2H2O Tác dụng được với nhiều muôn Ví dụ: H2SO„ + BaCL -> BaSO.J + 2HC1 Tính chất của axit sunfuric đặc: Tính chất oxi hóa mạnh: Axit sunfuric đặc, nóng có tính chất oxi hóa rất mạnh, nó oxi hóa được hầu hết các kim loại (trừ Au, Pt), nhiều phi kim (C, s, p,...) và nhiều hợp chát: 2H2SO4 + Cu —> CuSO,ị + 2H2O + SOọ 2H2SO4 + S _> 3 so2 + 2H2O 2H2SO4 + 2KBr -> Br2 + SO2+ 2H2O + K2SO„ Axit suníùric đặc, nguội làm một số kim loại như Fe, Al, Cr bị thụ động hóa. Tính chất háo nước: Axit sunfuric đặc Imp thụ mạnh nước. Ví dụ, nhỏ H2SO4 dặc vào đường saccarozơ thì có phản ứng: Ci2H22O,, + H2SO., -> 12C + H2SO,.11H2O Tiếp theo, một phần cacbon bị H2SO,t đạc oxi hóa thành khí co2 cùng với so2 bay lên làm sùi bọt, đấy cacbon trào ra ngoài. Phản ứng: c + 2HọS0, -> co,? + 2SO,? + 2H,0 Da thịt tiếp xúc với H,SO| đặc sẽ bị bỏng rất nặng, vì vậy khi sứ dụng axit sunfuric phải hết sức thận trọng. ứng dụng Axit sunfuric đặc là hóa chất hàng đầu được dùng trong nhiều ngành sản xuất. Hàng năm, các nước trên thế giới sản xuất khoáng 160 triệu tấn H,SO4. Axit sunfuric được dùng đế san xuá? phân bón. thuốc trừ sâu. chat giặt rửa tổng hợp, tơ sợi hóa học, chất déo, sơn màu, phàm nhuộm, dược phẩm, chế biến dầu mó,... Sản xuất axit sunfuric Axit sunfuric được sán xuất trong cõng nghiệp bang phương pháp tiếp xúc. Phương pháp này có 3 công đoạn chính: Sán xuát lưu huỳnh đinxit SOp Đốt cháy lưu huỳnh: s + 0, - > SO, Đốt quặng pirit sát FeS/ 4FeS, + 110, —> 2Fe,O.i + SSO, Sản xuất Lưu huỳnh trioxit so:1: Oxi hóa so,bằng khí oxi hoặc không khí du' ó' nhiệt dộ 450. - 500"C, chât xúc tác là V,Or,: 2SO, + O, 2SO. Hấp thụ SO;t bàng H2SO Dùng H,SOi 980 hấp thụ SO.I, được oleum H,SO(.nSO:i: H,so, + nSO.-i -4 H,SO,.nSO;; Sau đó dùng lượng nước thích hợp pha loãng oleum, dược II,SO( dặc: H,SO.,.nSO, + nlĩ,0 -> (n + 1)II,SO., II. MUỐI SUNFAT. NHẬN BIET ion SUNFAT Muôi sunfat Muôi sunfat. là muôi axit sunfuric. Có 2 loại muôi sunfat: Muôi trung hòa (muôi suníầt) chứa ion sunfat SO4 . Phần lớn muối sunfat đều tan trừ BaSOị, SrSO|, PbSO, không tan, Muôi axit (muối hidrosunfat) chua ion hidrosunfat HSO4 . Nhận biết ion sunfat Thuốc thử nhận biết ion sunfat SO4’ lã dung dịch muối bari. Sán phẩm phản ứng là bari sunfat BaSOi kết túa trang, không tan trong axit: H,S0| + BaCl, -> BaSO,ị + 2HC1 Na,so, + Ba(OII), -» BaSO,ị + 2NaOH B. BÀI TẬP Một hạp chát có thành phần theo khiii lượng 35.!)(>r'< S: 62.92'I o 1(1 1.12'r II. Họp chát này có công thức hóa học lủ: A. HọSO;! B. Ib.so, c. H2S/): 1). H2S// Chọn đáp án đúng: Giải Gọi công thức tống quát cùa (X) là: HXSVOZ I mH = %H = 1,12g Xét 100 gam (X) thì ms = GS = 35.96g [m0 = %0 = 62.92g ,= _ 1,12 35,96 62,92 2 2, Tỉ lệ: X : y : z = : 5 : 1 = 2 : 2 : 7 1 32 16 7 7 => Công thức hóa học của (X) là: HjSjO; Đáp án c Sô oxi hóa của lưu /luýnh trong một loại hợp chút oleum II2S/); là: A. +2 lì. +4 C. +6 I). +s Giải Trong H2S2O7, sô oxi hóa cùa s là: 2( + l) + 2(xJ + 7(-2) - 0" => X = +6 Đáp án c Có 4 lọ. mồi lọ đựng (lung dịch không máu: XaCI. IICI. Na-jSOi, lìu! \'():P2. Hãy phân biịd dung dịch dựng trong mòi lọ bồng phưangpháp hóa /lọc. \’iét phương trinh hóa học cua các phán ứng xúy ru. nêu co. Giải Trích mỗi dung dịch một ít làm mau thứ. cho quỳ tím lần lượt vào các mẫu thứ, mẫu thứ làm quỳ tím hóa dỏ là HC1. Cho vài giọt dung dịch BaCb vào 3 mầu thứ còn lại, mầu thứ tạo ra kết tủa trắng là ống nghiệm đựng dung dịch Xa2SO,|. BaCl2 + Na2SO, -> BaSOj + 2NaCl Cho vài giọt dung dịch Na-jSO) (dã biết) vào 2 mảu thứ còn lại, mầu nào có kết tủa trắng là dung dịch Ba(NO:;)ọ. Na,so, + Ba(NO;1), -» BaSO.ị + 2NaNO, - Còn lại là dung dịch NaCl, có thô khang định hằng dung dịch AgNO;;. AgNO.j + NaCl -> Agcũ + NaNO;;. al Aril sunfuric dạc dược dùng lùm khó nhưng khi dm. hay dull ru mọt CI dụ. Có nhưng khi úm không dược làm khô bòng nxit sunfuric dục. hãy (lun ru IIIỘI ci dụ. \ 'ì sao? bi Axit sunfuric dặc có thế biến nhiều hạp chút hưu cơ thành thun (dược gọi ìù sự háu than >. Dun ru nhiều vi dụ về sự hóa than cùa glucozu. saccarozu. ct Sự làm khỏ cà sự hóa than khác nhau như thè nào? Giải Axit H9SO4 đặc được dùng làm khô những khí ẩm, ví dụ: khí co2. Có những khí ẩm không được làm khô bằng H9SO4 đặc. Ví dụ-, khí H2S (vì H2S có tính khử nên có thê khử FI9SO4 đến so2). 3H2SO4 + H2S -> 4 so2 + 4H2O H9SO4 đặc làm than hóa một sô" châ"t hữu cơ. Ví dụ: - Với glucozơ: CfiH12O6 -> 6C + 6H9O - Với saccarozơ: C]2H220n -> 12C + 11H2O So sánh sự làm khô và sự hóa than. Sự làm khô là sự làm mất nước nhưng không thay đổi thành phần phân tử các chát. Sự hóa than là sự làm mất nước trong thành phần phân tử của các châ"t, do đó biến chất thành cacbon. a) Trong trường hạp nào axit sunfuric có những tinh chát hóa học chựng ciia. một axit? Đó là những tinh chất nào? Dẫn ra những phương trình hóa học của phan ứng để minh họa. Trong trường hạp nào axĩt sunfuric có những tinh chất hóa học dặc trưng? Đó là những tính chất nào? Dần ra những phương trình hóa học cùa phán ứng dể minh họa. Trong trường hợp axit sunfuric loãng sẽ có những tính chát hóa học chung của một axit. Làm quỳ tím hóa đỏ Tác dụng với kim loại hoạt động, giải phóng H2. Zn + H9SO4 -» ZnSO.1 + Họ Tác dụng với muôi của những axit yếu H9SO4 + K9CO3 -> K9SO4 + co2 + H2O Tác dụng với oxit bazơ H2SO4 + CuO CuSO4 + H2O Tác dụng với bazơ 2K0H + H9SO4 -> K9SO4 + 2HọO Trong trường hợp H9SO4 đặc sẽ có tính chất hóa học đặc trưng. Tính oxi hóa mạnh 2Fe + 6H9SO4 —> Fe2(SO,i)3 + 3SO2 + 6H2O c + 2H9SO4 -> 2SO2 + co2 + 2H9O 2HI + H9SO4 -» I2 + so2 + 2H2O Tính háo nước: Axit sunfuric đặc chiếm nước kết tinh của nhiều muôi hiđrat và làm than hóa các hợp chất: CuSO4.5H2O ——> CuSO4 + 5H2O màu xanh màu trắng C6H12O6 —> 6C + 6H2ó màu trắng màu đen Có 100 nil dưng dịch II1SO.1 98%, khôi lượng riêng là 1,84 g/cm3. Ngưàl ta muôn pha loãng thề tích H2SỌ4 trên thành dung dịch H2SO1 20%. Tinh thế tích nước cán dùng dề pha loãng. Khi pha loăng phải tiếh hành như thế nào? Giải a) Tính thể tích nước cần dùng để pha loãng. Khối lượng của 100 ml dung dịch H9SO4 98%. mddH2so4 = 100 X 1,84 = 184 (gam) Áp dụng quy tắc đường chéo mddH,SO4 : 98%' 20% 20%' mH2O : 0% mddH2SO4 H,0 20 78 H_,0 - 78% 184x78 20 = 717,6 gam. Khối lượng riêng của H2O bằng lg/ml nên thể tích của nước cần dùng là: Vh2o = 717,6 ml. b) Cách pha loãng Khi pha loãng phải rót từ từ axit H9SO4 đặc vào nước và khuây nhẹ, tuyệt đối không làm ngược lại (rót nước vào axit sunfuric đặc).