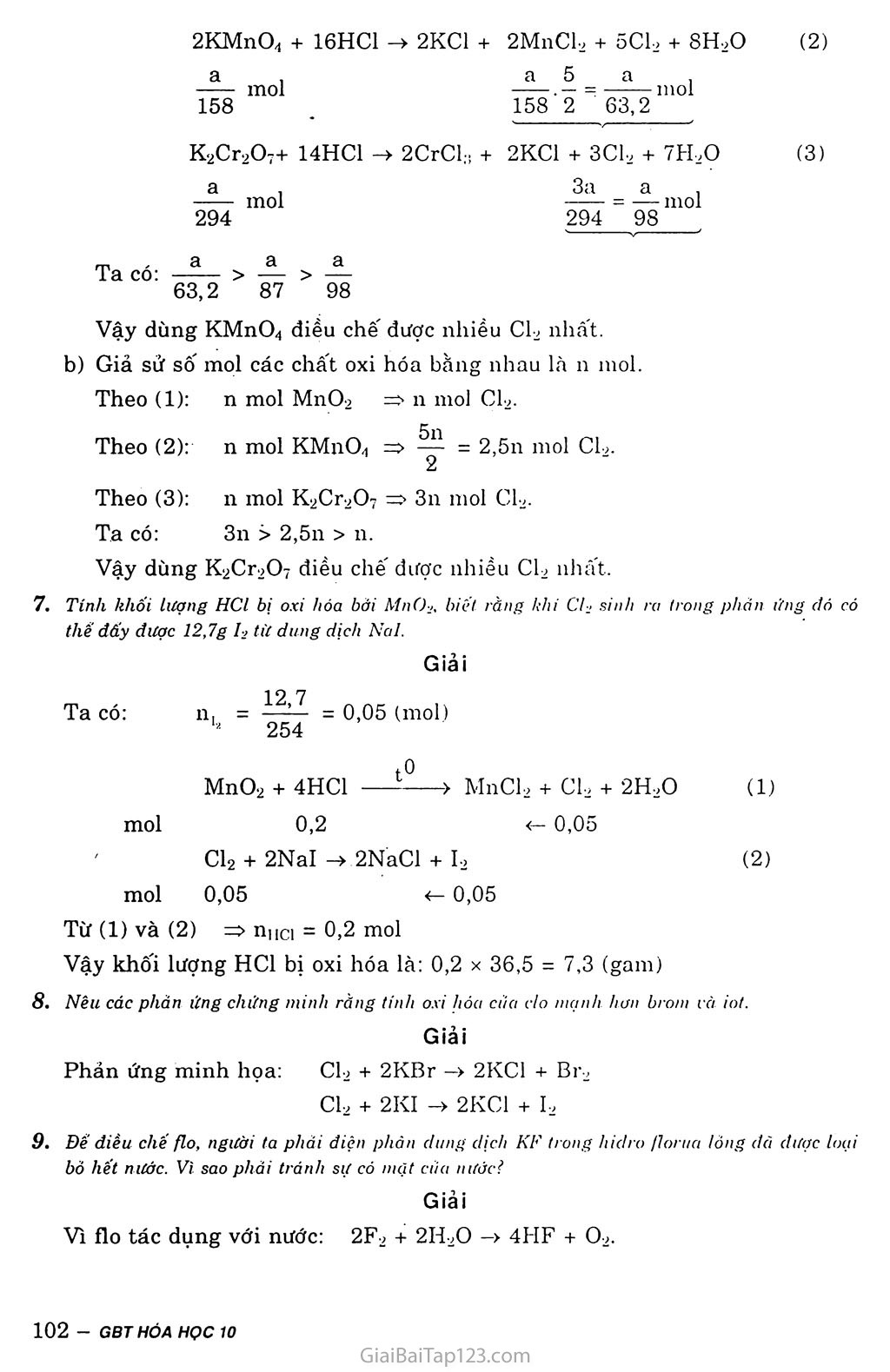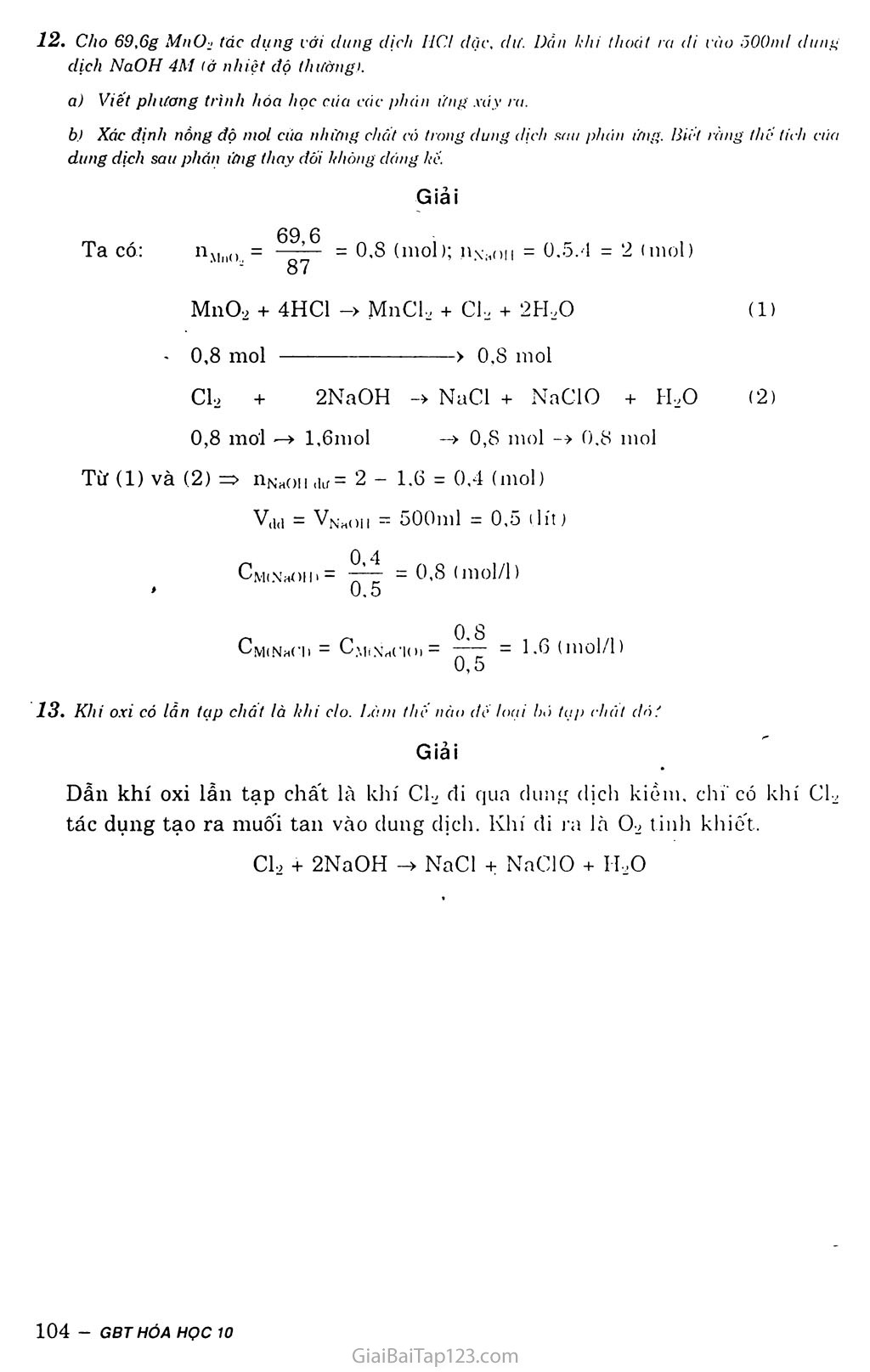Giải bài tập Hóa 10 Bài 26: Luyện tập: Nhóm halogen
§26. LUYỆN TẬP: NHÓM HALOGEN A. LÍ THUYẾT CẤU TẠO NGUYÊN TỬ VÀ PHÂN TỬ CỦA CÁC HALOGEN Bán kính nguyên tử tăng dần từ flo đến iot. Lớp ngoài cùng có 7 electron. Phân tử gồm 2 nguyên tử, liên kết cộng hóa trị không cực. Các halogen F C1 Br I Cấu hình electron lớp ngoài cùng 2s22p5 3s23p5 4s24p5 5s25p5 Cấu tạo phân tử (liên kết cộng hóa F : F C1 : C1 Br : Br I : I trị không cực) (F2) (Cl2) (Br2) (I2) II. TÍNH CHẤT HÓA HỌC Tính oxi hóa: Oxi hóa hầu hết kim loại, nhiều phi kim vằ hợp chất. Tính oxi hóa giảm dần từ flo đến iot. Các halogen F Cl Br I Độ âm điện 3,98 3,16 2,96 2,66 Tính oxi hóa Tính oxi hóa giảm dần Halogen Phản ứng f2 Cl2 Br2 b Với kim loại Oxi hóa được tất cả kim loại tạo ra muối tlorua ' Oxi hóa được hầu hết các kim loại tạo ra muối clorua, phản ứng cần đun nóng Oxi hóa được nhiều kim loại tạo ra muối bromua, phản ứng cấn đun nóng Oxi hóa dược nhiều kim loại tạo ra muối iotua, phản ứng chỉ xảy ra khi đun nóng hoặc có chất xúc tác Với khí hiđro Trong bóng tối, ở nhiệt độ thấp (-252°C) và nổ mạnh: F2+ H2-> 2HF Cẩn chiếu sáng, phản ứng nổ: Cỉ2+ H2 —> —>2HCI Cần nhiệt độ cao: Br2 + H2 —> . 2HBr Cần nhiệt độ cao hon: l2 + H2 > 2HI Với . nước Phân hủy mãnh liệt H20 ở ngay nhiệt độ thường: 2F2+ 2H2ũ -> -> 4HF + 02 ở nhiệt độ thường: CI2 + h20 HCI + HCIO ở nhiệt độ thường, chậm hon so vởi Cl2: Br2 + H20 HBr + HBrO Hầu như không tác dụng. TÍNH CHẤT HÓA HỌC CỦA HỘP chat halogen Axit halogenhiđric Dung dịch HF là axit yếu còn các dung dịch HC1, HBr, HI đều là các axit mạnh. HF HC1 HBr HI ) Tính axit tăng Hợp chất có oxi Nước Gia-ven và clorua vôi có tính tẩy màu và sát trùng do các muôi NaClO và CaOCl2 là các chất oxi hóa mạnh. PHƯƠNG PHÁP ĐIỀU CHẾ HALOGEN f2 Cl2 Br2 I2 Điện phân hỗn hợp KF và HF + Cho axit HC1 đặc tác dụng với chát oxi hóa mạnh như: MnO2, KM11O4... + Điện phân dung dịch NaCl có màng ngăn. Dùng CL đề oxi hóa NaBr (có trong rong biển) thành Br2. Sản xuất I2 từ rong biển. PHẢN BIỆT CÁC ION F“, cr, Br*, I Dùng AgNO3 làm thuốc thử: NaF + AgNO3 NaCl + AgNOa - không tác dụng AgClị + NaNOs (màu trắng) AgBrị + NaNO3 (màu vàng nhạt) Aglị + NaNO;i (màu vàng đậm) NaBr + AgNO3 Nai + AgNO3 B. BÀI TẬP A. HCl, HBr, HI, HF c. HI, HBr, HCl, HF B. IIBr. HI, HF, HCI. D. IIF, HCl, HBr, III Đáp án c 1. Dãy axit nào sau đây được sáp xếp đúng theo thứ- tự tinh axit. giăm dản: Đổ dung dịch ÁgNOi vào dung dịch muối nào sau dày sẽ không có phản ứng: A. NaF B. NaCl c. NaBr D.Nal. Giải NaF không phản ứng với AgNO3 vì AgF tan. Đáp án A Trong phản ứng hóa học sau: SOi + Br-2 + 2H2O -> II2SO4 + 2HBr Brom dóng vai trò: Chất khử. Chất oxi hóa. c. Vừa là chất oxi hóa, vừa là chất khử. D. Không là chất oxi hóa, không là chất khử. Chọn đáp án đúng. Giải so2 + Br2 + 2H2O —» H2SO,] + 2H Bi' Ta thây, số oxi hóa của brom giảm từ 0 -> -1 nên brom là clìât oxi hóa. Đáp án-B Chọn câu đúng khi nói về flo, clo, brotn, iot: Flo có tinh oxi hóa rất mạnh, oxi hóa mãnh liệt vái nước. Clo có tính oxi hóa mạnh, oxi hóa dược nước. Brom có tính oxi hóa mạnh, nhưng yếu han flo và clo, IIÓ cũng oxi hóa được nước. lot có tính oxi hóa yếu han flo, clo, brom nhưng cũng oxi hóa dược nước. Đáp án A Một nguyên tố halogen có cau'hinh electron lớp ngoài cùng cửa nguyên từ là 4s24p'. Viết cấu hình electron nguyên tử dầy đủ của nguyên tố trên. Cho biết tên, hi hiệu và cấu tạo phân tử của nguyên tố hóa học này. Nêu tinh chất hóa học cơ bán cùa nguyên lố này và dần ra những phán ứng hóa học dế minh họa. So sánh tinh chắt hóa học của nguyên tố này với 2 nguyên tô halogen khác dứng trên và dưới nó trong nhóm halogen và dần ra phán ứng hóa học để minh họa. Giải Cấu hình electron đầy đủ là: ls22s22p63s23pH3dll)4s24p5. Đó là brom, kí hiệu Br, cấu tạo phân tử: Br - Br. Tính chất hóa học cơ bản của brom là tính oxi hóa. Oxi hóa được nhiều kim loại. 3Br2 + 2A1 -> 2AlBr;i Tác dụng với hiđro ở nhiệt độ cao. Br2 + H, —-> 2HBr Tác dụng với nước tạo HBr và HBrO. Br2 + H2O -ị > HBr + HBrO Brom có tính oxi hóa mạnh nhưng yếu hơn clo và mạnh hơn iot. Clo oxi hóa muôi natri bromua thành brom. Clọ + 2NaBr -> 2NaCl + Br2 Brom oxi hóa muối natri iotua thành iot: Br2 + 2NaI -> 2NaBr + I2 Có những chát sau: KMnOi, MnO-i, KjCr-eOi và dung dịch HCI. Nếu các chất oxi hóa có khối lượng bùng nhau thì chọn chát nào có the diều chẽ dược lượng khi clo nhiều haul Nếu các chất oxi hóa có số moi bồng nliau thì chọn chất nao có thố diều chế dược lượng khi clo nliiều han ? Hãy trá lài báng cách tinh toán trên ca sớ cùa các phương trinh hóa học của phản ứng. Giải a) Giả sử lấy lượng mỗi chất là a gam. (2) 2KMnO4 + 16HC1 -> 2KC1 + 2MnCl, + 5C1, + 8H,0 158 mol 158'2 63,2 mol (3) 294 mol 3a 294 9S - mol Ta CÓ: 63,2 87 98 Vậy dùng KMndj điều chế được nhiều Cl2 nhất, b) Giả sử số mol các chất oxi hóa bằng nhau hà 11 mol. Theo (1): n mol MnO2 => 11 mol Cl2. 5n Theo (2): n mol KMnO.ị ~>'J= 2,5n mol Cl2. 2 Theo (3): n mol K2Cr2O7 => 3n mol Cl2. Ta có: 3n > 2,5n > n. Vậy dùng K2Cr2O- điều chế được nhiều Cl2 nhất.. 7. Tinh khối lượng HCl bị oxi hóa bới MnOj, biết ràng khi Clí sinh ra trong phản ứng đổ có thể đấy được 12,7g 1-2 từ dung dịch Nai. Giải 12,7 Ta có: 254 = 0,05 (mol) MnO2 + 4HC1 lO -> MnCl2 + C1, + 2H2O 0,2 <— 0,05 Cl2 + 2NaI -> 2NaCl + I2 mol 0,05 <— 0,05 Từ (1) và (2) => niici = 0,2 mol Vậy khối lượng HC1 bị oxi hóa là: 0,2 X 36,5 = 7,3 (gain) 8. Nêu các phản ứng chứng minh ráng tinh oxi hóa của clo mạnh han brom và iot. Giải mol (1) (2) Phản ứng minh họa: Cl2 + 2KBr —> 2KC1 + Br2 cụ + 2KI -> 2KC1 + I2 9. Đế diều chế flo, người ta phăi điện phàn dung dịch KF h ong hidro florua lỏng dà được loại bỏ hết nước. Vỉ sao phải tránh sự có mật ciia nước? Giải Vì flo tác dụng với nước: 2F2 + 2H2O —> 4HF + 02. K2Cr2O7+ 14HC1 -> 2CrCl, + 2KC1 + 3C12 + 7FI,0 Giải X + y = 0,025 103x = 58,5y. nAgNO3 - 100.170 = 0,025 (mol) NaBr + AgNOa —> AgBrị + NaNO3 (1) X mol -> xmol -> X mol NaCl + AgNO3 -> AgCU + NaNOa (2) y mol -> y mol -> y mol ỉ 0. Một dung dịch có liòa tan hai muối là NaBi' và NaCl. Nồng độ phần trăm của mỗi muối trong dung dịch đều bằng nhau và bàng c%. Hãy xác định nồng độ c% của hai muối trong dung dịch, biết rằng 50g dung dịch hai muối nói trên tác dụng vừa dii với 50ml dung dịch AgNOs 8%, khôi lượng riêng D = 1,0625 gỉ cm3. Do nồng độ phần trăm của hai muôi bằng nhau và khối lượng dung dịch là 50g nên khôi lượng hai muôĩ phải bằng nhau. Đặt số mol NaBr, NaCl là X, y ta có hệ phương trình: Giải hệ phương trình được: X « 0,009 Vậy: mNaBr = mNaci = 103.0,009 = 0,927 (g) 0 927 c% = ^ì^.100 = 1,86 (%) 50 Cho 300ml một dung dịch có hòa tan 5,85g NaCl tác dụng với 200ml .dung dịch có hòa tan 34g AgNOi, người ta thu dược một kết tủa và nước lọc. Tính khối lượng chắt kết túa thu dược. Tính nồng độ mol chất còn lại trong nước lọc. Cho lằng thế tích nước lọc thu dược không thay dối dáng kể., Giải Ta có: nNaci = = 0,1 (mol) 58,5 nAgNO3 = = 0,2 (mol) Tính khôi lượng kết tủa: NaCl + AgN0.3 -> AgCU + NaNO3 (1) (mol) 0,1 -» 0,1 -> 0,1 -> 0,1 Từ (1) => nAgci = 0,1 mol mAgciị = 0,1 X 143,5 = 14,35 (g) Tính Cm- Ta có: v,id = 300 + 200 = 500 (ml) = 0,5 (lít) Từ (1) => dung dịch thu được chứa ÍNaNO3 : O,lmol [AgNOgdư : 0,2 - 0,1 = O,l(mol) Vậy CM|NHNO3> = CM(AgNó3đư) = = 0,2 (mol/1) Cho 69,6g MnCL tác dụng với dung dịch HCI dộc, dư. Dằn khi thoát ra di vào SOOnil dung dịch NaOH 4M tở nhiệt độ thường). Viết phương trình hóa học ciia các phán ưng xáy ra. Xác định nồng độ niol cùa nhưng elicit có trong dung dịch sau phùn ừng. Diet rang the tích Clio dung dịch sau phân íứig thay dổi lthông dáng he. Giải 69 ổ Ta có: nM„(, = = 0.8 (moì); ịi.\’hoii = 0,5.4 = 2 (moi) 87 MnO2 + 4HC1 -> MnCl, + Ch + 2H,0 (1) • 0,8 mol > 0,8 mol C1, + 2NaOH -> NaCl + NaClO + H,0 (2) 0,8 moi —> l,6mol —> 0,8 mol —» 0,8 moi Từ (1) và (2) => nNaoiì đư= 2 - 1.6 = 0,4 (moi) V(1(1 = VNtl()ii = 500ml = 0,5 (lit) Cm(NhOiii = 77— = 0,8 (mol/1) » 0,5 CminhCìi = Cm(nhC|()i= = 1.6 (mol/1) 0,5 Khi oxi có lần teip chát là khi do. Làm thi' nào di' loai bó tạp chát dó? Giải Dần khí oxi lẫn tạp chất là khí cụ đi qua dung dịch kiềm, chi'có khi Ch tác dụng tạo ra muối tan vào dung dịch. Khí đi ra là 0-2 tinh khiêt. C1, + 2NaOH -> NaCl + NaClO + 11,0