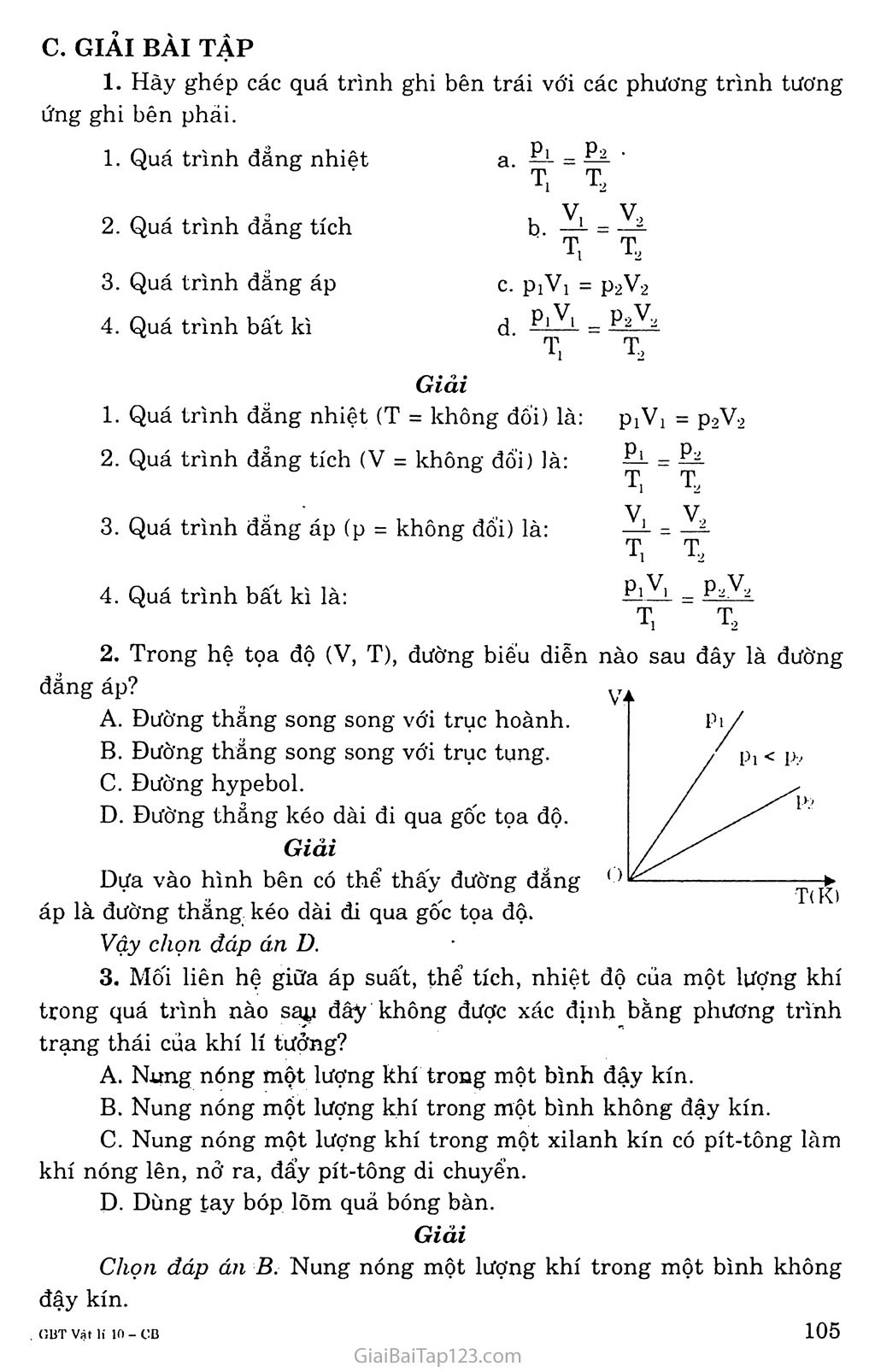Giải Vật Lý 10 Bài 31. Phương trình trạng thái của khí lí tưởng
Bài 31. PHƯƠNG TRÌNH TRẠNG THÁI CỦA KHÍ LÍ TƯỞNG A. KIẾN THỨC CẦN NAM vững Khí thực và khí lí tưởng Những thí nghiệm chính xác cho thấy, các chất khí thực chỉ tuân theo gần đúng các định luật Bôi-lơ - Ma-ri-ốt và Sác-lơ. Giá trị của tích pV và của hệ số a thay đổi theo bản chất, nhiệt độ và áp suất của chất khí. Chỉ có khí lí tưởng là tuân theo đúng các định luật Bôi-lơ - Ma-ri-ốt và Sác-lơ. Trong điều kiện áp suất không lớn lắm và không đòi hỏi độ chính xác cao, có thể áp dụng hai định luật này đế’ tính áp suất, thể tích và nhiệt độ của khí thực. Phương trình trạng thái của khí lí tưởng Phương trình: Tl t2 Một cách tống quát, có thê viết: = hăng sô. Phương trình trên được nhà vật lí người Pháp Clapêrôn đưa ra năm 1834 và được gọi là phương trình trạng thái của khí lí tưởng hay phương trình Clapêrôn. Quá trình đẳng áp Quá trình biêh đổi trạng thái khi áp suất không đổi gọi là quá trình đẳng áp. Liên hệ giữa thể tích và nhiệt độ tuyệt đối trong quá trình đẳng áp p V, p.,v„ Từ phương trình = -L - ta thấy khi Pi = P2 (nghĩa là khi áp T2 V V, V suất không đối) thì 44 = 44 hay 77 = hằng sô. Tj T2 T Trong quá trình đẳng áp, thể tích của một lượng khí xác định tỉ lệ với nhiệt độ tuyệt đổì. Đường đẳng áp Đường biểu diễn sự biến thiên của thể tích theo nhiệt độ khi áp suất không đổi gọi là đường đẳng áp. Độ không tuyệt đôi Kenvin đã đưa ra một nhiệt giai bắt đầu từ 0°K và 0°K gọi là độ không tuyệt đối. Các nhiệt đối trong nhiệt giai của Kenvin đều có giá trị dương và mỗi độ chia trong nhiệt giai này cũng bằng mỗi độ chia trong nhiệt giai Xenxiut. Chính xác thì độ không tuyệt đối thấp hơn -273°c một chút (vào khoảng -273,15°C). B. TRẢ LỜI CẢU HỎI (1) (2) Cl. — Lượng khí được chuyến từ trạng thái 1 sang trạng thái 1’ bằng quá trình nào? Hãy viết biểu thức liên hệ giữa P1, V1 và p’, v2. - Lượng khí được chuyến từ trạng thák 1’ sang'trạng thái 2 bằng quá trình nào? Hãy viết biểu thức liên hệ giữa P’, Tị và p2, T2. Trả lời Quá trình chuyễn từ trạng thái 1 sang trạng thái 1’ là quá trình đẳng nhiệt (Ti không đổi). Biểu thức liên hệ: piVi = pV2. Quá trình chuyển từ trạng thái 1’ sang trạng thái 2 là quá trình đẳng tích (V2 không đổi). Biểu thức liên hệ: 7^- = 7^4. c. GIẢI BÀI TẬP 1. Hãy ghép các quá trình ghi bên trái với các phương trình tương ứng ghi bên phải. 1. Quá trình đẳng nhiệt a. ỄHỄr T( T2 2. Quá trình đảng tích V, V., b.-^L = ^ ■ T, T2 3. Quá trình đẳng áp c. PìVi = p2V2 4. Quá trình bất kì d p» V1 - P2V2 T, T2 Giải 1. Quá trình đẵng nhiệt (T = không đổi) là: P1Ỹ! = p2V2 2. Quá trình đẳng tích (V = không đổi) là: P1 _ P2 T, T 3. Quá trình đẳng áp (p = không đổi) là: Vị.= V, Tt Tã 4. Quá trình bất kì là: P1V. T. t2 nào sau đây là đường Trong hệ tọa độ (V, T), đường biểu diễn đẵng áp? Đường thẳng song song với trục hoành. Đường thẳng song song với trục tung, c. Đường hypebol. D. Đường thẳng kéo dài đi qua gốc tọa độ. Giải Dựa vào hình bên có thể thấy đường đẳng áp là đường thẳng kéo dài đi qua gốc tọa độ. Vậy chọn đáp án D. Mối liên hệ giữa áp suất, thể tích, nhiệt độ của một lượng khí trong quá trình nào sap đâý không được xác định bằng phương trình trạng thái của khí lí tưởng? Nung nóng một lượng khí trong một bình đậy kín. Nung nóng một lượng khí trong một bình không đậy kín. c. Nung nóng một lượng khí trong một xilanh kín có pít-tông làm khí nóng lên, nở ra, đẩy pít-tông di chuyến. D. Dùng tay bóp lõm quả bóng bàn. Giải Chọn đáp áìi B. Nung nóng một lượng khí trong một bình không đậy kín. Trong phòng thí nghiệm, người ta điều chế được 40cm3 khí hiđrô ở áp suất 750mmHg và nhiệt độ 27°c. Tính thế tích của lượng khí trên ở điều kiện chuẩn (áp suất 760mmHg và nhiệt độ 0°C). Giải Lúc đầu ta có: V! = 40cm3; P1 = 750 (mmHg); T1 = 300°K Sau đó ta có: V-2 = ?; p2 = 760 (mmHg); T2 = 273°K Áp dụng phương trình trạng thái, ta có: Vọ T2.P1VỊ 273.750.40 300.760 = 36 (cm3). Tính khối lượng riêng của không khí ở đính núi Phăng-xi-păng cao 3140m. Biết rằng mỗi khi lên cao thêm 10m thì áp suất khí quyến giảm ImmHg và nhiệt độ trên đình núi là 2°c. Khối lượng riêng cúa không khí ở điều kiện chuẩn (áp suất 760mmHg và nhiệt độ 0°C) là l,29kg/m3. Giải Khối lượng riêng là khối lượng của không khí trong lm3. Vậy Vo = V = lm3. Áp suất khí quyển tại chân núi là: Pkq - ——77—— = 0.987 (atm) = 750,12 (mmHg) 1.013.105 Áp suất tại đỉnh núi là: p = pKQ - 314 = 436,12 (mmHg) (1) (2) Theo phương trình Clepêrôn - Menđêleép -7“ = -j^-R , ta có: Khối lượng riêng tại 0°C là: = Do TqR Vo Khối lượng riêng tại 2°c là: = 77 = D TR V Lấy (2) chia cho (1) ta có: D pM T0R = pT Do TR ■ POM POT Vậy khối lượng riêng của không khí tại đỉnh núi là: = 0,735 (kg/m3). d=dP^,l29.436 12 273 °p0T 760.275