SGK Hóa Học 8 - Bài 22: Tính theo phương trình hóa học
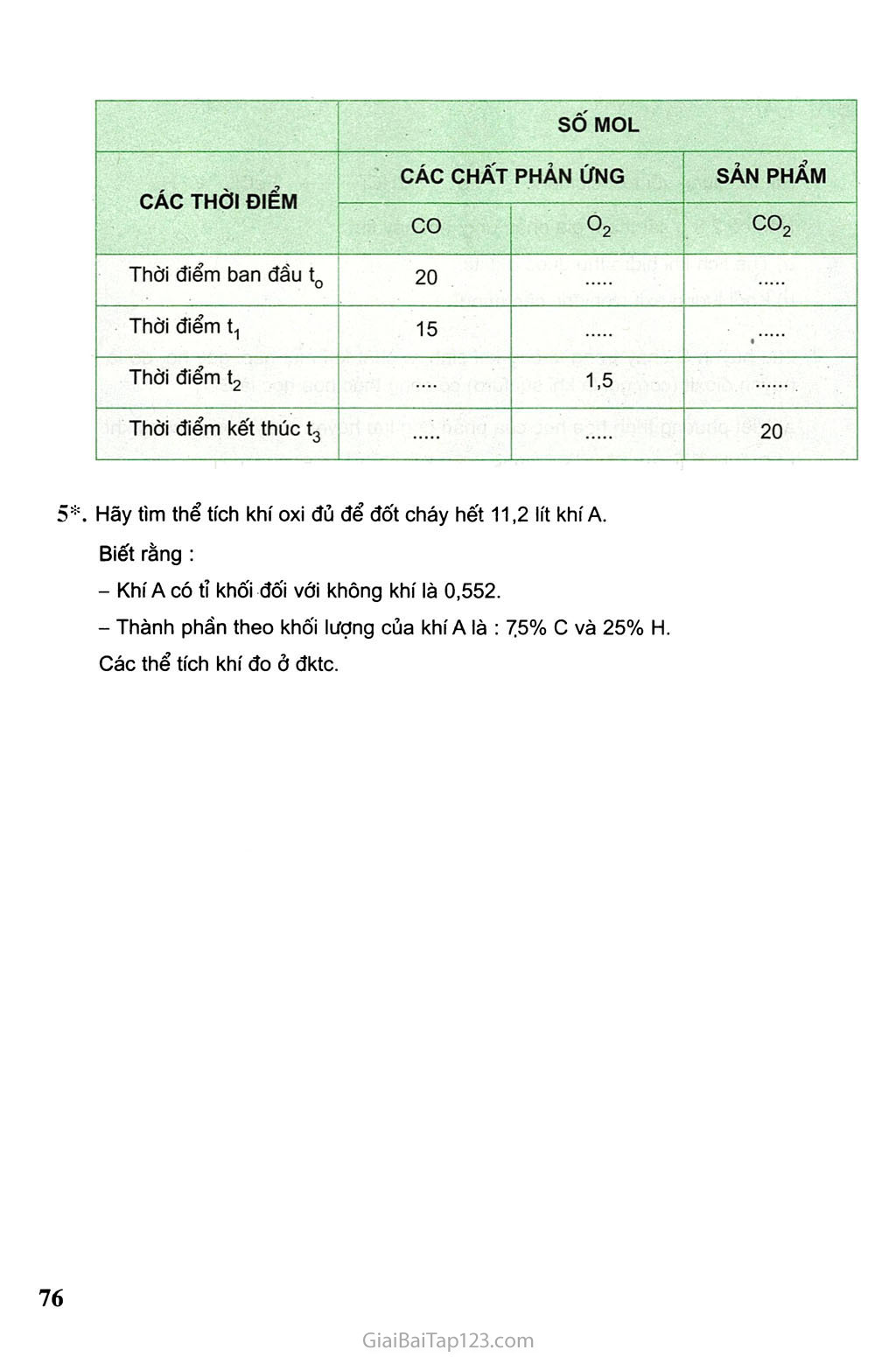
Bản quyền thuộc Nhà xuất bản Giáo dục Việt Nam - Bộ Giáo dục và Đào tạo Mã số : 2H807T5 01-2015/CXB/238-902/GD Bông thổm dung dịch amoniac \ Giấy quỳ tím tẩm nước (2) "'■■'=?rs!±=il=o’75(ni01’ MCaO 56 Tìm số mol CaCO3 tham gia phản ứng. Theo phương trình hoá học : Muốn điều chế được 1 mol CaO cần phải nung 1 mol CaCO3. Vậy muốn điều chế được 0,75 mol CaO cần phải nung 0,75 mol CaCO3. Tìm khối lượng CaCO3 cần dùng : mCaCO3 = n x McaCO3 = 0,75 X100 = 75 (g). Bằng cách nào có thể tìm được thể tích chất khí tham gia và sản phẩm ? Thí dụ 1 Cacbon cháy trong oxi hoặc trong không khí sinh ra khí cacbon đioxit : c + 02 -£-> co2 Hãy tìm thể tích khí cacbon đioxit CO2 (đktc) sinh ra, nếu có 4 g khí oxi tham gia phản ứng. Các bước tiến hành : Tìm số mol khí oxi tham gia phản ứng : nạ = ^ = 0,125 (mol) Tim số mol CO-, sinh ra sau phản ứng : Theo phương trình hoá học : 1 mol 0? tham gia phản ứng, sinh ra 1 mol CO2. Vậy: 0,125 molO2 0,125 mol CO2. Tim thể tích khí COọ (đktc) sinh ra sau phản ứng : VCŨ2 = 22,4 X n = 22,4 X 0,125 = 2,8 (1). Thí dụ 2 Hãy tìm thể tích khí oxi (đktc) cần dùng để đốt cháy hoàn toàn 24 g cacbon. Các bước tiến hành : Viết phưcmg trình hoá học của cacbon cháy trong oxi : c + 02 CO2 Tìm số mol c tham gia phản ứng : nc = Ậ-= 2 (mol) c 12 Tìm số mol 09 tham gia phản ứng : Theo phưofng trình hoá học : Đốt cháy 1 mol c cần dùng 1 mol O2. Vậy : Đốt cháy 2 mol c cần dùng 2 mol O,. Tìm thể tích khí oxi cần dùng (đktc) : VOi= 22,4 X n = 22,4 X 2 = 44,8 (1). Các bước tiến hành : Viết phương trinh hoá học. Chuyển đổi khối lượng chất hoặc thể tích chất khí thành sô moi chất. Dựa vào phương trình hoá học để tìm số mol chất tham gia hoặc chất tạo thành. Chuyển đổi sô' mol chất thành khối lượng (m = n X M) hoặc thể tích khí ở đktc (V = 22,4 X n). BÀI TẬP sắt tác dụng với axit clohiđric : Fe + 2HCI > FeCI2 + H2. Nếu có 2,8 g sắt tham gia phản ứng, em hãy tìm : Thể tích khí hiđro thu được ở đktc. Khối lượng axit clohiđric cần dùng. Lưu huỳnh s cháy trong không khí sinh ra chất khí mùi hắc, gây ho, đó là khí lưu huỳnh đioxit (còn gọi là khí suníurơ) có công thức hoá học là SO2. Viết phương trình hoá học của phản ứng lưu huỳnh cháy trong không khí. Biết khối lượng lưu huỳnh tham gia phản ứng là 1,6 g. Hãy tìm : Thể tích khí lưu huỳnh đioxit sinh ra ở đktc. Thể tích không khí cần dùng ở đktc. Biết khí oxi chiếm 1/5 thể tích của không khí. Có phương trình hoá học sau : t° CaCO3 —-—> CaO + CO2 Cần dùng bao nhiêu mol CaCO3 để điều chế được 11,2 g CaO ? ' Muốn điều chế được 7 g CaO cần dùng bao nhiêu gam CaCO3 ? Nếu có 3,5 mol CaCO3tham gia phản ứng sẽ sinh ra bao nhiêu lít co2 (đktc) ? Nếu thu được 13,44 lít khí co2 ở đktc thì có bao nhiêu gam chất rắn tham gia và tạo thành sau phản ứng ? 4*. a) Cacbon oxit co tác dụng với khí oxi tạo ra cacbon đioxit. Hãy viết phương trình hoá học. Nếu muốn đốt cháy 20 mol co thì phải dùng bao nhiêu mol O2 để sau phản ứng người ta chỉ thu được một chất khí duy nhất ? Hãy điền vào những ô trống số mol các chất phản ứng và sản phẩm có ở những thời điểm khác nhau. Biết hỗn hợp co và O2 ban đầu được lấy đúng tỉ lệ về số mol các chất theo phương trình hoá học. SÔ' MOL CÁC THỜI ĐIỂM CÁC CHẤT PHẢN ỨNG SẢN PHẨM CO °2 co2 Thời điểm ban đầu t0 20 Thời điểm t1 15 « Thời điểm t2 1,5 Thời điểm kết thúc t3 20 5*. Hãy tìm thể tích khí oxi đủ để đốt cháy hết 11,2 lít khí A. Biết rằng : Khí A có tỉ khối đối với không khí là 0,552. Thành phần theo khối lượng của khí A là : 75% c và 25% H. Các thể tích khí đo ở đktc.