SGK Hóa Học 11 - Bài 1: Sự điện ly
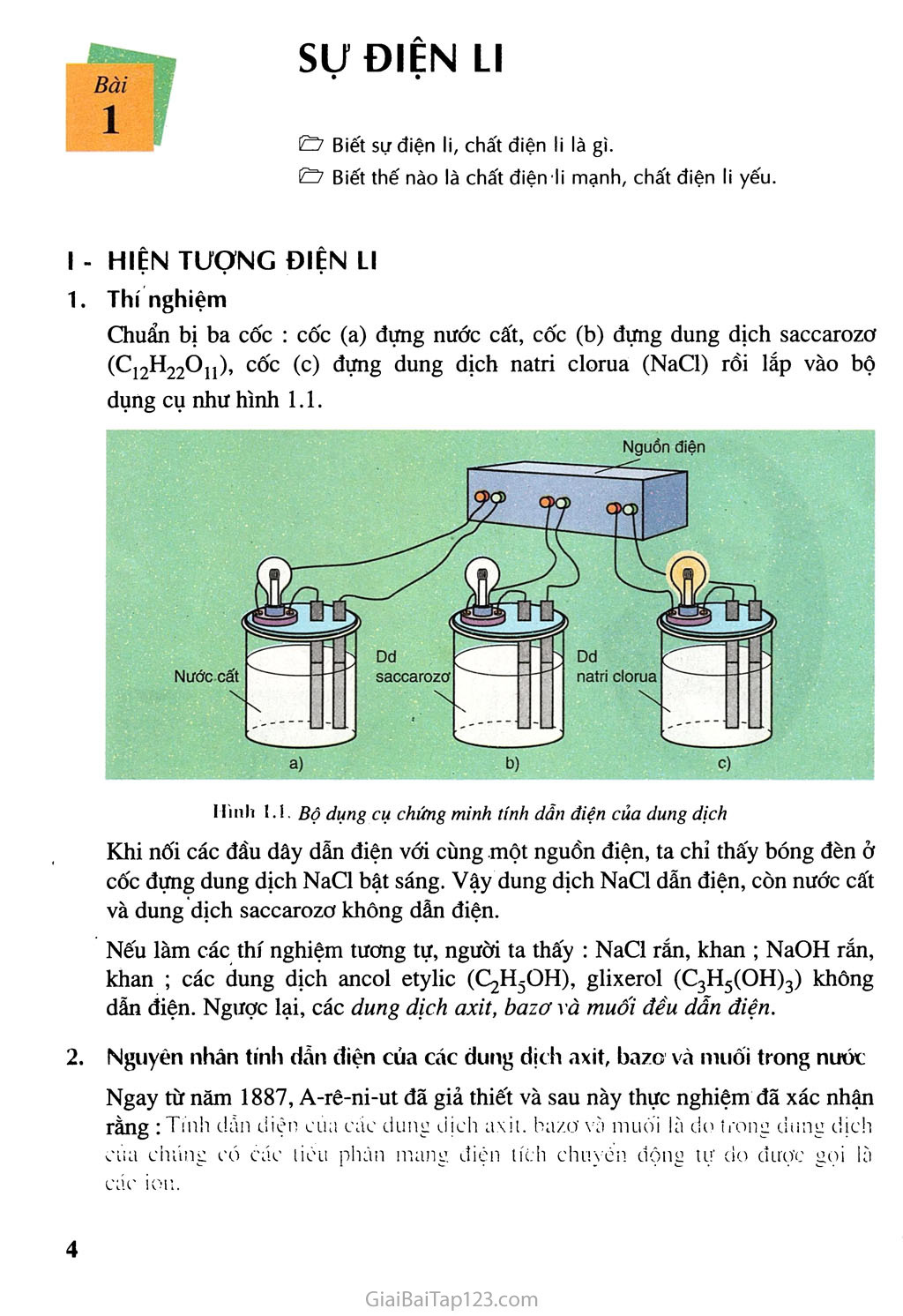
Chương -a —\J sụ 1HỊ .V 1,1 Khi các axit, bazơvà muối hoà tan trong nước xảy ra những hiện tượng gì ? Phản ứng xảy ra trong dung dịch nước có những đặc điểm gì ? A-rè-ni-ut (S. Arrhenius, 1859- 1927), người Thụy Điển, được giải Nô-ben về Hoá học năm 1903 Mội loại máy đo pH được dùng trong phòng thí nghiệm gRfc Sự ĐIỆN LI Bài 1 & Biết sự điện li, chất điện li là gì. & Biết thế nào là chất điện li mạnh, chất điện li yếu. - HIỆN TƯỢNG ĐIỆN LI Thí nghiệm Chuẩn bị ba cốc : cốc (a) đựng nước cất, cốc (b) đựng dung dịch saccarozơ (Cị2H220ịị), cốc (c) đựng dung dịch natri clorua (NaCl) rồi lắp vào bộ dụng cụ như hình 1.1. Hình !. Bộ dụng cụ chứng minh tính dẫn điện của dung dịch Khi nối các đầu dây dẫn điện với cùng .một nguồn điện, ta chỉ thấy bóng đèn ở cốc đựng dung dịch NaCl bật sáng. Vậy dung dịch NaCl dẫn điện, còn nước cất và dung dịch saccarozo không dẫn điện. Nếu làm các thí nghiệm tương tự, người ta thấy : NaCl rắn, khan ; NaOH rắn, khan ; các dung dịch ancol etylic (C2H3OH), glixerol (C3H5(OH)3) không dẫn điện. Ngược lại, các dung dịch axit, bazơ và muối đều dẫn điện. Nguyên nhân tính dẫn điện của các dung dịch axit, bazơ và muối trong nuớc Ngay từ năm 1887, A-rê-ni-ut đã giả thiết và sau này thực nghiệm đã xác nhận rằng : Tính dẫn điện của các dung dịch axit, bazơ và mụối là do trong dung dịch của chúng có các tiểu phân mang điện tích chuyển động tự do được gọi là các ion. Như vậy các axit, bazơ và muối khi hoà tan trong nước phân li ra các ion, nên dung dịch của chúng dẫn điện. Quá trình phân li các chất trong nước ra ion là sự điện li. Những chất tan trong nước phân li ra ion được gọi là những chất, điện liO). Vậy axit. bazơ và muối là những chất điện li. Sự điện li được biểu diễn bằng phương trình điện li. NaCl > Na+ + Cl- un y TT+ + Cl- rid > 11 NaOH - > Na4 + OH- - PHÂN LOẠI CÁC CHẤT ĐIỆN LI Thí nghiệm Chuẩn bị hai cốc : một cốc đựng dung dịch HC1 0,1 OM, cốc kia đựng dung dịch CH3COOH 0,10M và lắp vào bộ dụng cụ như hình 1.1. Khi nối các đầu dây dẫn điện với cùng một nguồn điện, ta thấy bóng đèn ở cốc đựng dung dịch HC1 sáng hơn so với bóng đèn ở cốc đựng dung dịch CH3COOH. Điều đó chứng tỏ rằng : nồng độ ion trong dung dịch HC1 lớn hơn nồng độ ion troụg dung dịch CH3COOH, nghĩa là số phân tử HC1 phân li ra ion nhiều hơn so với số phân tử CH3COOH phân li ra ion. Dựa vào mức độ phân li ra ion của các chất điện li khác nhau, người ta chia các chất điện li thành chất điện li mạnh và chất điện li yếu. Chất điện li mạnh và chất điện li yếu Chất điện li mạnh Chất điện li mạnh là chất khi tan trong nước(2\ các phân tử hoà tan đều phân li ra ion. í1’ Nhiều chất khi nóng chảy cũng phân li ra ion, nên ở trạng thái nóng chảy các chất này dẫn điện được. (2) Tất cả các chất đều ít nhiều tan trong nước. Thí dụ, ở 25°c nồng độ bão hoà của BaSO4 là 1,0.10-5 mol/1, của AgCl là l,2.10“5 mol/1, của CaCO3 là 6,9.10-5 mol/1, của Fe(OH)2 là 5,8.10-6 mol/1. Thí dụ, NaCl là chất điện li mạnh. Nếu trong dung dịch có 100 phân tử NaCl hoà tan, thì cả 100 phân tử đều phân li ra ion. Những chất điện li mạnh là các axit mạnh như HC1, HNO3, HC1O4, H2SO4, ... ; các bazơ mạnh như NaOH, KOH, Ba(OH)2, Ca(OH)ọ ... và hầu hết các muối. Trong phương trình điện li của chất điện li mạnh, người ta dùng một mũi tên chỉ chiều của quá trình điện li. Thí dụ : Na2SO4 > 2Na+ + soj" Vì sự điện li của Na2SO4 là hoàn toàn, nên ta dễ dàng tính được nồng độ các ion do Na2SO4 phân li ra. Thí dụ, trong dung dịch NaọSCXị 0,1 OM, nồng độ ion Na+ là 0,20M và nồng độ ion so4~ là 0,10M. Chất điện li yếu Chất điện li yếu là chất khi tan trong nước chi có một phần số phân tử hoà tan phân li ra ion, phần còn lại vẫn tồn tại dưới dạng phân tử trong dung dịch. Thí dụ, trong dung dịch CH3COOH 0,043M, cứ 100 phân tử hoà tan có 2 phân tử phân li ra ion, còn lại 98 phân tử không phân li. Vậy, CH3COOH là chất điện li yếu. Những chất điện li yếu là các axit yếu như CH3COOH, HC1O, HọS, HF, H2SO3,...; các bazơ yếu như Bi(OH)3, Mg(OH)2,... Trong phương trình điện li của chất điện li yếu, người ta dùng hai mũi tên ngược chiều nhau. Thí dụ-. CH3COOH CH3COO-+H+ Sự phân li của chất điện li yếu là quá trình thuận nghịch, khi nào tốc độ phân li và tốc độ kết hợp các ion tạo lại phân tử bằng nhau, cân bằng của quá trình điện li được thiết lập. Cân hằng điện li là cân b,ằng động. Giống như mọi cân bằng hoá học khác, cân bằng điện li cũng tuân theo nguyên lí chuyển dịch cân bằng Lơ Sa-tơ-li-ê. BÀI TẬP Các dung dịch axií như HCI, bazơ như NaOH và muối như NaCI dẫn điện được, còn các dung dịch như ancol etylic, saccarozơ, glixerol không dẫn điện là do nguyên nhân gì ? Sự điện li, chất điện li là gì ? Những loại chất nào là chất điện li ? Thế nào là chất điện li mạnh, chất điện li yếu ? Lấy thí dụ và viết phương trình điện li của chúng. Viết phương trình điện li của những chất sau : Các chất điện li mạnh : Ba(NO3)2 0,1 OM ; HNO3 0.020M ; KOH 0,01 OM. Tính nồng độ mol của từng ion trong các dung dịch trên. Các chất điện li yếu : HCIO, HNO2. Chọn câu trả lời đúng trong các câu sau đây : Dung dịch chất điện li dẫn điện được là do sự chuyển dịch của các electron. sự chuyển dịch của các cation. c. sự chuyển dịch của các phân tử hoà tan. D. sự chuyển dịch của cả cation và anion. Chất nào sau đây không dẫn điện được ? KCI rắn, khan. CaCI2 nóng chảy, c. NaOH nóng chẵy. D. HBr hoà tan trong