SGK Hóa Học 11 - Bài 29: Anken
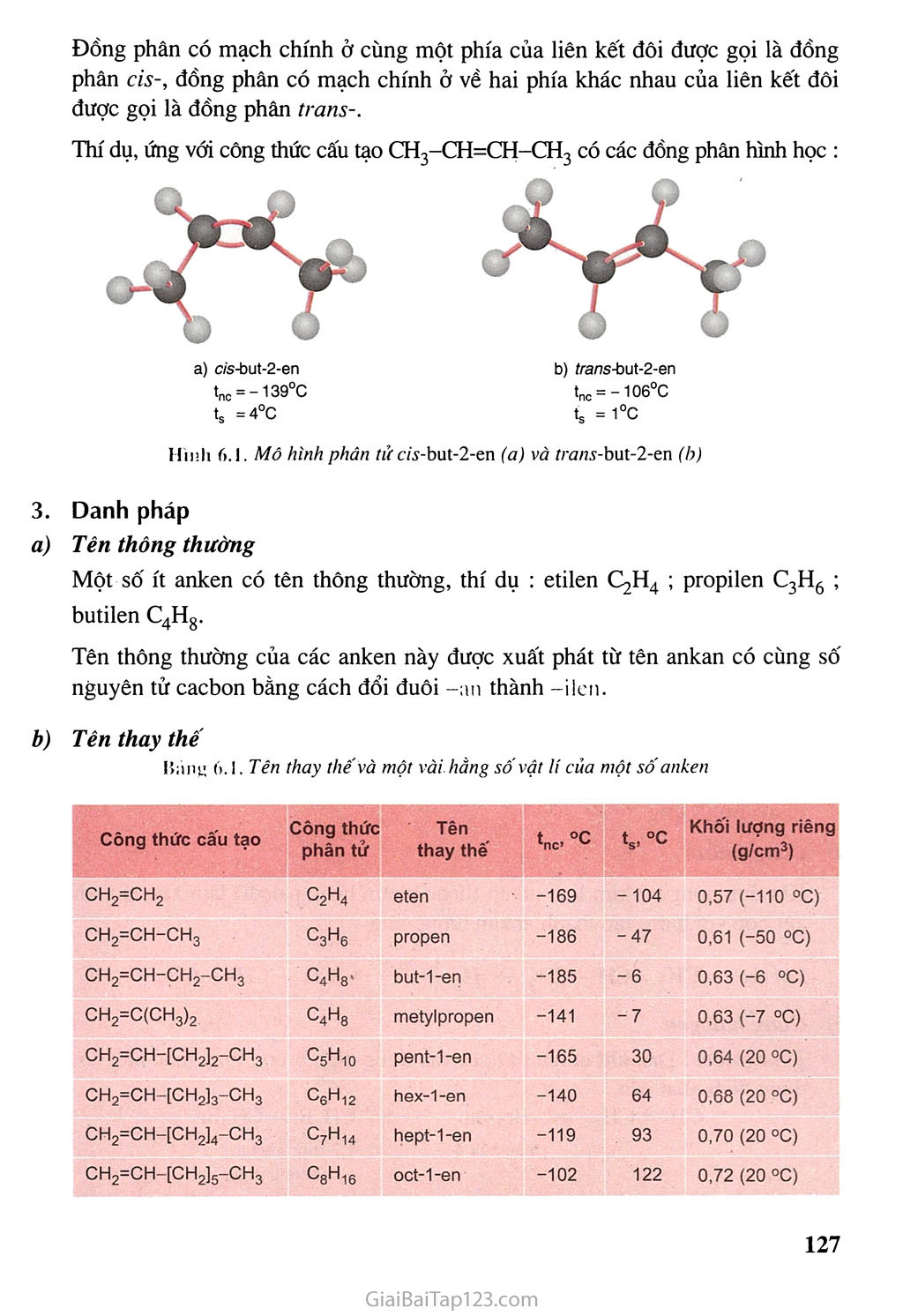
TƯỜNG TRÌNH Chương S' IIIDKOCACItOX \Q KHÒXGĂO Khái niệm về hiârocacbon không no và một vài loại hiđrocacbon không no tiêu biểu: anken, ankin, ankađien. ■ ÍD Tính chất hoá học của anken, ankin, ankaâien. Một số ứng dụng quan trọng của anken, ankỉn và ankađien. Lốp xe được sản xuất từ cao su buna Hiđrocacbon không no là những hiđrocacbon trong phân tử có liên kết đôi c = c hoặc liên kết ba c= c hoặc cả hai loại liên kết đó. Anken là những hiđrocacbon mạch hở trong phân tử có một liên kết đôi c= c. Ankin là những hiđrocacbon mạch hở trong phân tử có một liên kết ba C--C. ANKEN Ankađien là những hiđrocacbon mạch hỗ trong phán tử có hai liên kết đôi c= c. & Biết cấu tạo phân tứ, cách gọi tên và tính chất cúa anken. & Biết cách phân biệt anken với ankan bằng phương pháp hoá học. I - ĐỎNG ĐẲNG, ĐỒNG PHẢN, DANH PHÁP Dãy đồng đảng anken Etilen (CH2 = CH2) và các chất tiếp theo có công thức phân tử C3H6, C4H8, C5H10,... có tính chất tương tự etilen lập thành dãy đồng đẳng có công thức phân tử chung CnH2ll (n > 2) được gọi là anker hay olefin. Đồng phân ữ) Đồng phân cấu tạo Etilen và propilen không có đồng phân anken. Từ C4Hg trở đi, ứng với một công thức phân tử có các đồng phân anken về vị trí liên kết đôi và về mạch cacbon. Thí dụ, ứng với công thức phân tử C4H8 có các đồng phân anken với công thức cấu tạo sau : ch2=ch-ch2-ch3 ch3-ch=ch-ch3 ch2=c-ch3 ch3 Đồng phân hình học Trong phân tử anken, mạch chính là mạch cacbon dài nhất có chứa liên kết đôi c=c. Những anken mà mỗi nguyên tử cacbon ở vị trí liên kết đôi liên kết với hai nhóm nguyên tử khác nhau sẽ có sự phân bố không gian khác nhau của mạch chính xung quanh liên kết đôi. Sự phân bố khác nhau đó tạo ra đồng phân về vị trí không gian của các nhóm nguyên tử gọi là đồng phân hình học. Đồng phân có mạch chính ở cùng một phía của liên kết đôi được gọi là đồng phân CÌS-, đồng phân có mạch chính ở về hai phía khác nhau của liên kết đôi được gọi là đồng phân trans-. Thí dụ, ứng với công thức cấu tạo CH3-CH=CH-CH3 có các đồng phân hình học : tnc = -139°C ts =4°c b) frans-but-2-en tnc = -106°C ts = 1°c Mô hình phân tử c/í-but-2-en (a) và Zran.v-but-2-en (b) Danh pháp Tên thông thường Một số ít anken có tên thông thường, thí dụ : etilen C,H4 ; propilen C3H6 ; butilen C4Hg. Tên thông thường của các anken này được xuất phát từ tên ankan có cùng số nguyên tử cacbon bằng cách đổi đuôi an thành -ilen. Tên thay thế Báng 6. Tên thay thếvà một vài hằng sốvật lí của một sốanken Công thức cấu tạo Công thức phân tử Tên thay thê' tnc °C ts,°c Khôi lượng riêng (g/cm3) ch2=ch2 C2H4 eten -169 -104 0,57 (-110 °C) ch2=ch-ch3 CgHg propen -186 -47 0,61 (-50 °C) ch2=ch-ch2-ch3 c4h8. but-1-en -185 -6 0,63 (-6 °C) CH2=C(CH3)2 c4h8 metylpropen -141 -7 0,63 (-7 °C) CH2=CH-[CH2]2-CH3 C5H10 pent-1-en -165 30 0,64 (20 °C) CH2=CH-[CH2]3-CH3 csh12 hex-1-en -140 64 0,68 (20 °C) CH2=CH-[CH2]4-CH3 c7h14 hept-1-en -119 93 0,70 (20 °C) CH2=CH-[CH2]5-CH3 ’-'8^16 oct-1-en -102 122 0,72 (20 °C) Tên thay thế của anken được xuất phát từ tên ankan tương ứng bằng cách đổi đuôi -an thành -en. Từ C4H8 trở đi, trong tên anken cần thêm số chỉ vị trí nguyên tử cacbon đầu tiên chứa liên kết đôi. Mạch cacbon được đánh số từ phía gần liên kết đôi hơn. 4 3 2 1 Thí dụ-. CHn-CH = C-CHo I ch3 2-metylbut-2-en - TÍNH CHẤT VẬT LÍ Một số hằng số vật lí của các anken đầu dãy đồng đẳng được trình bày trong bảng 6.1. Ớ điều kiện thường, các anken từ C2H4 đến C4Hg là chất khí; từ C5H10 trở đi là chất lỏng hoặc chất rắn. Nhiệt độ nóng chảy, nhiệt độ sồi và khối lượng riêng của các anken tăng dần theo chiều tăng của phân tử khối. Các anken đều nhẹ hơn nước (D < 1 g/cm3) và không tan trong nước. - TÍNH CHẤT HOÁ HỌC Liên kết đói c=c gồm một liên kết ơ và một liên kết 71. Liên kết 71 kém bền hơn liên kết ơ nên dễ bị phân cắt hơn, gây nên tính chất hoá học đặc trưng của anken : dễ dàng tham gia phản ứng cộng tạo thành hợp chất no tương ứng. Phản ứng cộng Cộng hiđro Khi đun nóng có kim loại niken (hoặc platin hoặc palađi) làm xúc tác, anken kết hợp với hiđro tạo thành ankan tương ứng. Thí dụ : CH2 = CH - CH3 + H2 Ni,t° > CH3 - CH2 - CH3 Cộng halogen Thí nghiệm : Dãn khí etilen từ từ đi vào dung dịch brom, thấy màu nâu đỏ của dung dịch nhạt dần. CH2 = CH2 + Br2(dd) > CH2Br-CH2Br (màu nâu đỏ) 1,2-đibrometan (không màu) Rót dung dịch brom vào cốc đựng anken (lỏng) thấy dung dịch brom mất màu (hình 6.2). Hình 6.2. Dung dịch brom tác dụng với anken lỏng Phản ứng trên được dùng để phân biệt anken với ankan. Các đồng đẳng của etilen đều làm mất màu dung dịch brom. Cộng HX (X là OH, Cl, Br,...) Các anken cũng tham gia phản ứng cộng với nước, với hiđro halogenua (HC1, HBr, HI), với các axit mạnh. Thí dụ : CH2=CH2 + H-OH —1 —> CH3 - CH2 - OH CH2=CH2 + H-Br > CH3 - CH2 - Br Thí dụ : CH, Các anken có cấu tạo phân tử không đối xứng khi tác dụng với HX có thể sinh ra hỗn hợp hai sản phẩm. CH, — CH — CH, (Sản phẩm chính) CH = CH2 + HBr J I Br 2-brompropan CH3 — CH2 — CH2Br (Sản phẩm phụ) 1-brompropan Quy tắc cộng Mac-côp-nhi-côp (1838-1904) : Trong phản ứng cộng HX vào liên kết đôi, nguyên tử H (hay phần mang điện dương) chủ yếu cộng vào nguyên tử cacbon bậc thấp hơn (có nhiều H hơn), còn nguyên tử hay nhóm nguyên tử X (phần mang điện âm) cộng vào nguyên tử cacbon bậc caộ hơn (có ít H hơn).' Phản ứng trùng họp Ở nhiệt độ cao, áp suất cao và có chất xúc tác thích hợp, các phân tử anken có thể kết hợp với nhau tạo thành những phân tử có mạch rất dài và phân tử khối lớn. Thí dự'. ... + ch2 = ch2 + ch2 = ch2 + ch2 = ch2 + ... t0’P’xt > ..ch2-ch2-ch2-ch2-cĩí2-ch2- ... Phương trình hoá học trên có thể viết gọn như sau : nCH2 = CH2 t0’P’xt > < CH2 - CH2% etilen polietilen (PE) Phản ứng như trên được gọi là phản ứng trùng hợp. Phản ứng trùrig hợp (thuộc loại phản ứng polime hoá) là quá trình kết hợp liên tiếp nhiều phán tử nhỏ giống nhau hoặc tương tự nhau tạo thành những phân tử rất lớn (gọi là polime). Chất đầu (C^pụ tham gia phản ứng trùng hợp được gọi là monome. Sản phẩm n là polime. Phần trong dấu ngoặc -CH2-CH2- được gọi là mắt xích của polime ; n là hệ số trùng hợp, thường lấy giá trị trung bình. Phản ứng oxi hoá Phản ứng oxi hoá hoàn toàn Khi bị đốt vói oxi, etilen và các đồng đẳng đều cháy và toả nhiều nhiệt: C„H2n + y 02 nCO2 + nH2O Phản ứng oxi hoá không hoàn toàn Thí nghiệm : Sục khí etilen vào dung dịch KMnO4, thấy màu của dung dịch nhạt dần và có kết tủa nâu đen của MnO2. 3CH2=CH2 + 4H2O + 2KMnO4 > 3HO-CH2-CH2-OH + 2MnO2ị + 2K0H Các đồng đẳng của etilen cũng làm mất màu dung dịch KMnO4. Phản ứng này được dùng để phân biệt anken với ankan. - ĐIỀU CHÊ 1. Trong phòng thí nghiệm Etilen được điều chế từ ancol etylic (hình 6.3) : C2H5OH —H2SO4 đặc,i70 °C > CH2 = CH2 + H2O Hình 6.3. Điêu chế etilen từ ancol etylìc 2. Trong công nghiệp Các anken được điều chế từ ankan : c„H'2n+2 ^c„h2„+h2 - ÚNG DỤNG Các anken và dẫn xuất của anken là nguyên, liệu cho nhiều quá trình sản xuất hoá học. Etilen, propilen, butilen được dùng làm chất đầu tổng hợp các polime có nhiều ứng dụng. Nguyên liệu cho công nghiệp hoá học cơ BÀI TẬP So sánh anken với ankan về đặc điểm cấu tạo và tính chất hoá học. Cho thí dụ minh hoạ. ứng với công thức phân tử C5H10 có bao nhiêu anken đồng phân cấu tạo ? A. 4 B. 5 c. 3 D. 7 Viết phương trình hoá học của phản ứng xảy ra khi : Propilen tác dụng với hiđro, đun nóng (xúc tác Ni). But-2-en tác dụng với hiđro clorua. Metylpropen tác dụng với nước có xúc tác axit. Trùng hợp but-1-en. Trình bày phương pháp hoá học để : Phân biệt metan và etilen. Tách lấy khí metan từ hỗn hợp với etilen. Phân biệt hai bình không dán nhãn đựng hexan và hex-1-en. Viết phương trình hoá học của các phẩn ứng đã dùng. Chất nào sau đây làm mất màu dung dịch brom ? A. butan ; B. but-1-en ; c. cacbon đioxit; D. metylpropan. Dẩn từ từ 3,36 lít hỗn hợp gồm etilen và propilen (đktc) vào dung dịch brom thấy dung dịch bị nhạt màu và không còn khí thoát ra. Khối lượng dung dịch sau phản ứng tăng 4,90 gam. Viết các phương trình hoá học và giải thích các hiện tượng ở thí nghiệm trên. Tính thành phần phần trăm về thể tích của mỗi khí trong hỗn hợp ban đầu. 'ỉu liệu LỊCH SỬ PHÁT MINH RA POLIETILEN Vào năm 1933, khi tiến hành phản ứng giữa etilen và benzandehit ở 1 70 °C dưới áp suất 1400 atm, người ta không thu được sản phấm cộng hợp giữa hai chất. Nhưng một nhà hoá học đã chú ý đến lớp mỏng chất rắn màu trắng như sáp bám trên thành của thiết bị. Đó chính là polietilen. Tuy nhiên, thí nghiệm tương tự chỉ với etilen lại không thu được kết quả. Hai năm sau, khi làm giảm áp suất một cách đột ngột và sau đó bơm etilen vào thiết bị ở 180 °C, người ta lại thu được polietilen. Kết quá trên được giải thích : Trong quá trình bơm etilen vào thiết bị đã có một lượng nhó khí oxi vào theo và chính khí oxi đó đã làm xúc tác cho phản ứng tạo polime của etilen.