SGK Hóa Học 11 - Bài 35: Benzen và đồng đẳng - Một số hiđrocacbon thơm khác
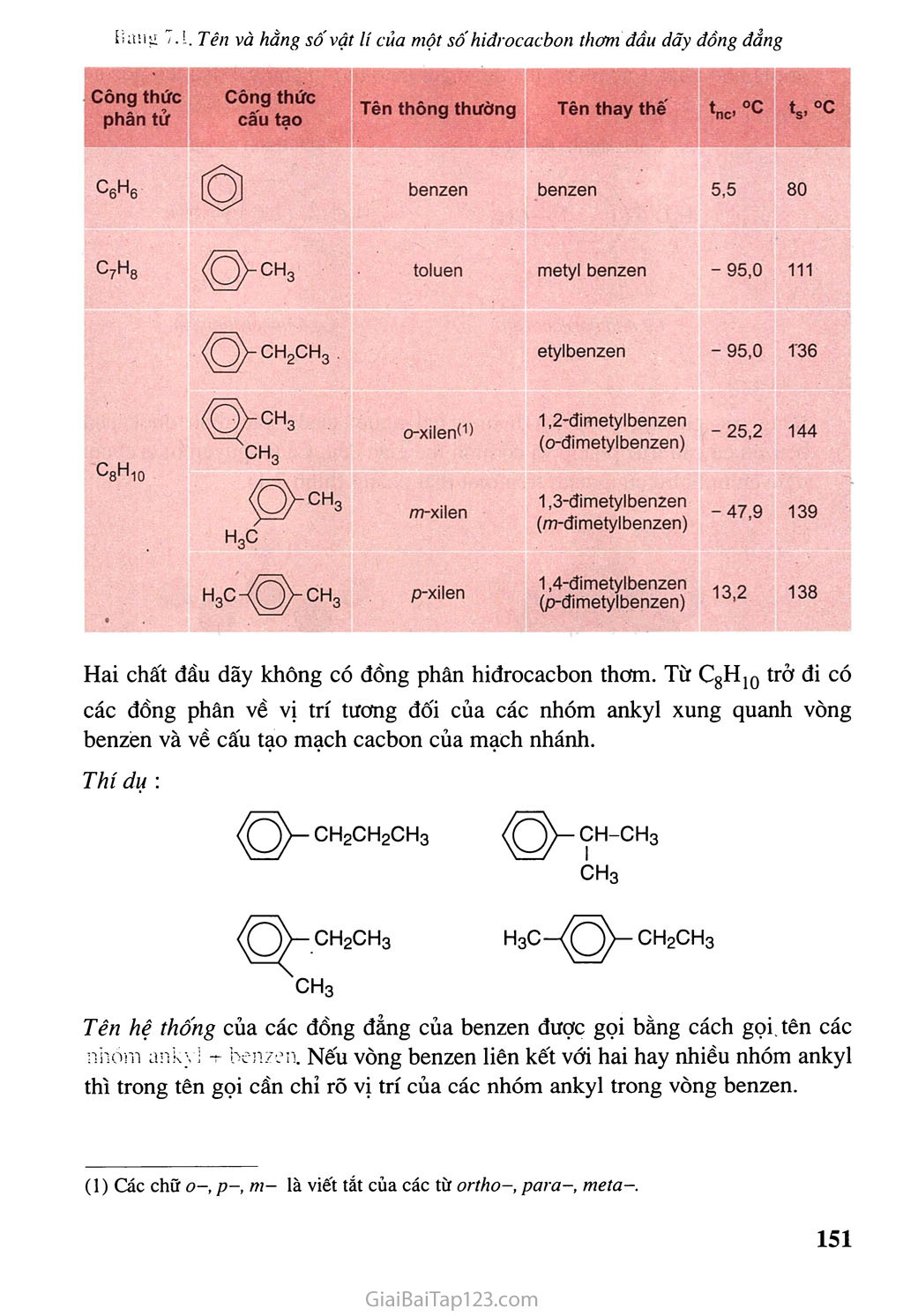
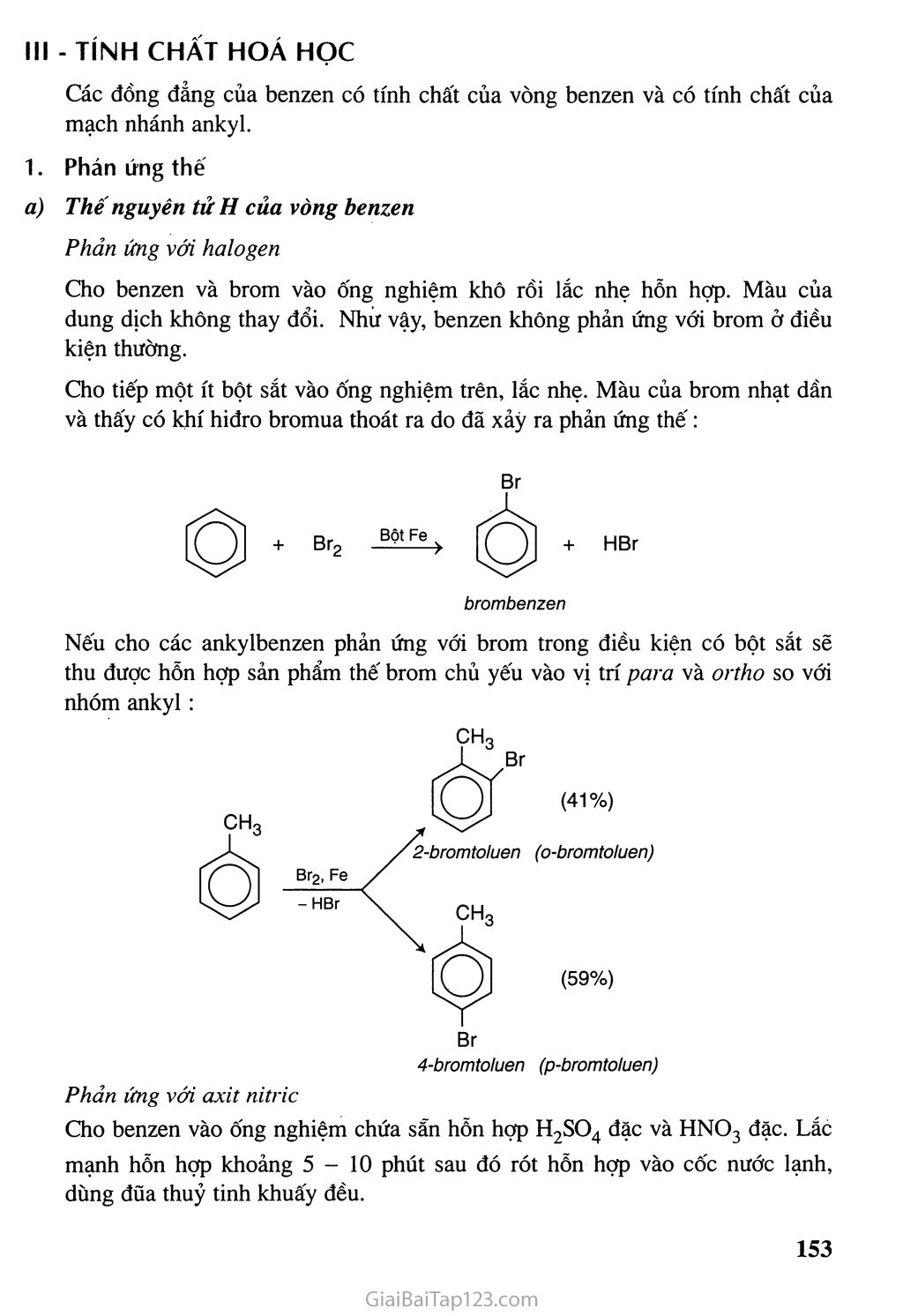
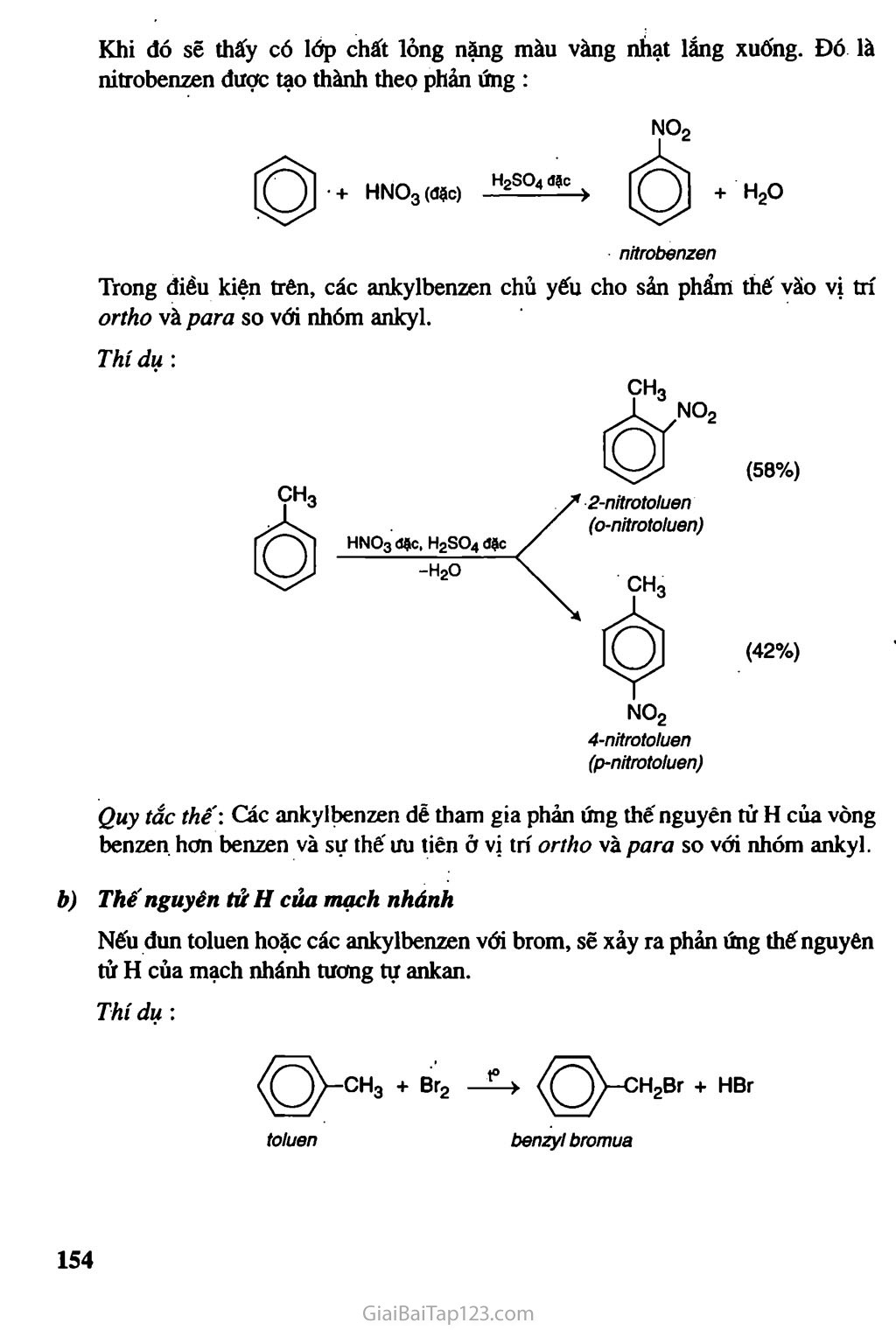
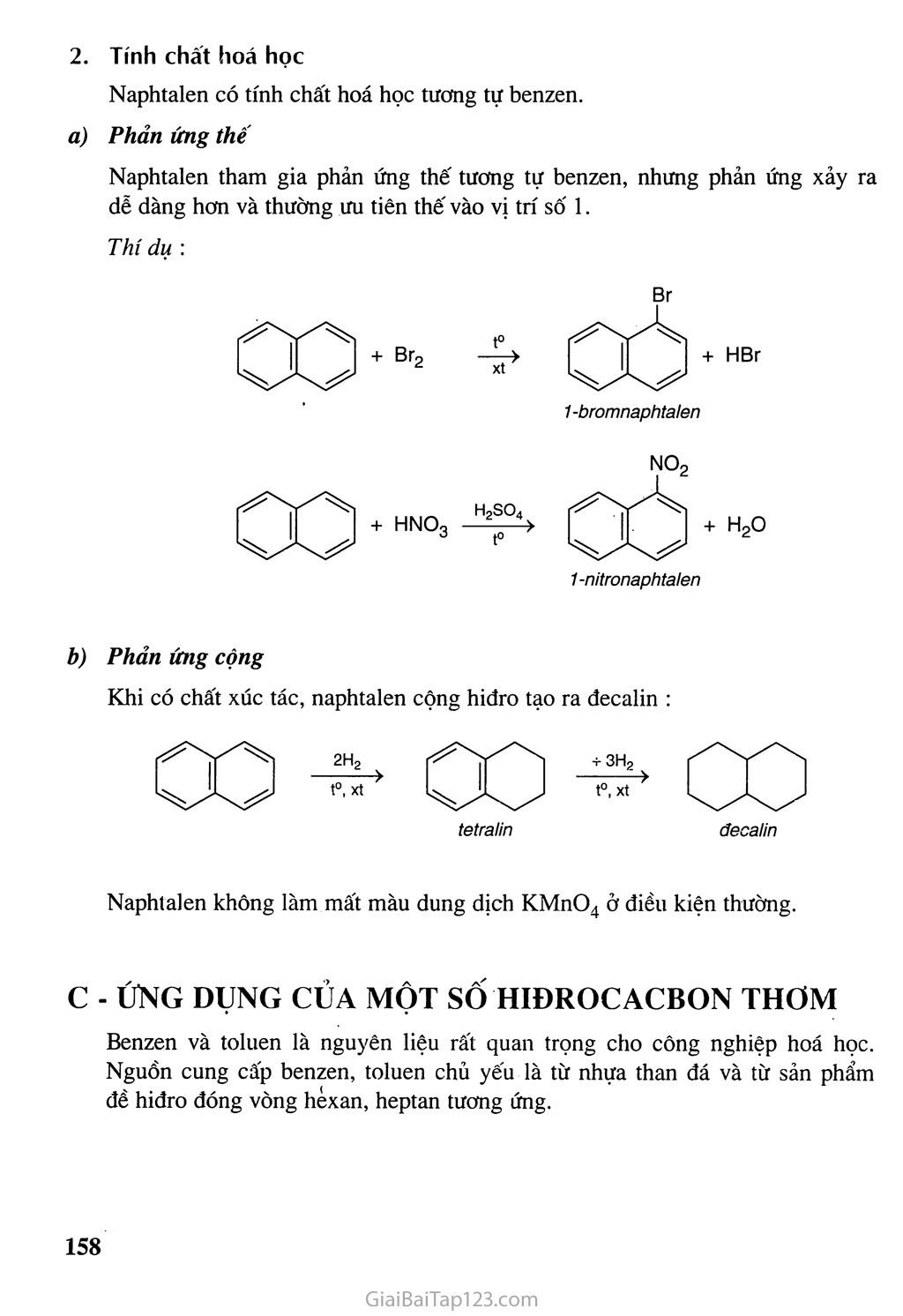
Chương HIĐROCACBON THƠM NGtrÒN IIHHỈOCACBON THIÊN NHIÊN HỆ THỐNG HOÁ VỀ HỈĐROCACBON Hiđrocacbon thơm : Khái niệm, đồng phân, danh pháp, tính chất hóa học • Các nguồn hiđrocacbon thiên nhiên và ứng dụng chính của chúng. Sự chuyển hóa giữa các loại hiđrocacbon đã học. Kê-ku-lê (F.A. Kekulé, 1829-1896), người tìm ra công thức cấu tạo của benzen Hiđrocacbon thơm là những hiđrocacbon trong phân tử có chứa một hay nhiều vòng benzen. Các hiđrocacbon thơm được chia thành : — Hiđrocacbon thơm có một vòng benzen trong phân tử, thí dụ : — Hiđrocacbon thơm có nhiều vòng benzen trong phân tử, thí dụ : Hiđrocacbon thơm là nguồn nguyên liệu quan trọng của công nghiệp tổng hợp polime, dược phẩm, phẩm nhuộm... BENZEN VÀ ĐỒNG ĐANG. MỘT SỐ HIĐROCACBON THƠM KHÁC & Biết đặc điểm cấu tạo cúa benzen và biết cách gọi tên một vài hiđrocacbon thơm đơn gián. & Biết viết các phương trình hoá học minh hoạ tính chất hoá học cúa benzen và đi ng đẳng của benzen, stiren và naphtalen. A - BENZEN VÀ ĐồNG ĐANG I - ĐỒNG ĐẲNG, ĐỒNG PHÂN, DANH PHÁP, CẤU TẠO Dãy đồng đẳng của benzen Benzen C6H6 và các hiđrocacbon thơm khác có công thức phân tử là CyHg (toluen), CgH10,lập thành dãy đồng đẳng có công thức phân tử chung (n > 6). Đồng phân, danh pháp Một số hiđrocacbon thơm đầu dãy đồng đẳng có công thức cấu tạo và tên gọi được trình bày trong bảng 7.1. . Tên và hằng sô'vật lí của một sô' hiđrocacbon thơm đầu dãy đồng đẳng Công thức phân tử Công thức cấu tạo Tên thông thường Tên thay thế ‘no °C ‘s>°c ^6^6 0 benzen benzen 5,5 80 C7Hg OCH3 toluen metyl benzen - 95,0 111 <g^CH2CH3 etylbenzen - 95,0 T36 *^8^10 O-CH3 ch3 o-xilenO) 1,2-đimetylbenzen (o-đimetylbenzen) - 25,2 144 ^>CH3 h3c m-xilen 1,3-đimetylbenzen (m-đimetylbenzen) -47,9 139 « h3c43^ch3 p-xilen 1,4-đimetylbenzen (p-đimetylbenzen) 13,2 138 Hai chất đầu dãy không có đồng phân hiđrocacbon thơm. Từ CgHịQ trở đi có các đồng phân về vị trí tương đối của các nhóm ankyl xung quanh vòng benzen và về cấu tạo mạch cacbon của mạch nhánh. Thí dụ : -ch-ch3 ch3 Q-ch2ch3 h3c-^3^ch2ch3 ch3 Tên hệ thống của các đồng đẳng của benzen được gọi bằng cách gọi tên các nhóm ankỵ 1 + benzen. Nếu vòng benzen liên kết với hai hay nhiều nhóm ankyl thì trong tên gọi cần chỉ rõ vị trí của các nhóm ankyl trong vòng benzen. (1) Các chữ O-, p-, m- là viết tắt của các từ ortho-, para-, meta-. Đánh số các nguyên tử cacbon của vòng benzen sao cho tổng chỉ số trong tên gọi là nhỏ nhất. Các nhóm thế được gọi theo thứ tự chữ cái đầu tên gốc ankyl. Thí dụ : Cách đánh sô đúng 1,2,4-trimetylbenzen 1,4,6-trimetylbenzen Cấu tạo Bằng các phương pháp vật lí hiện đại người ta đã xác định được phân tử benzen có cấu trúc phẳng và có hình lục giác đều. Cả 6 nguyên tử cacbon và 6 nguyên tử hiđro cùng nằm trên một mặt phẳng (hình 7.1). Hình 7.1. Mô hình phân tửbenzen dạng đặc (a) và dạng rỗng (b) Để thể hiện cấu tạo của benzen, ngày nay người ta dùng một trong hai công thức cấu tạo sau : II - TÍNH CHẤT VẬT LÍ Các hiđrocacbon thơm đều là chất lỏng hoặc rắn ở điều kiện thường, chúng cỏ nhiệt độ sôi tăng theo chiều tăng của phàn tử khối. Các hiđrocacbon thơm ở thể lỏng có mùi đặc trưng, không tan trong nước và nhẹ hơn nước, có khả năng hoà tan nhiều chất hữu cơ. Ill - TÍNH CHẤT HOÁ HỌC Các đồng đẳng của benzen có tính chất của vòng benzen và có tính chất của mạch nhánh ankyl. 1. Phản ứng thế Thế nguyên tủ H của vòng benzen Phản ứng với halogen Cho benzen và brom vào ống nghiệm khô rồi lắc nhẹ hỗn hợp. Màu của dung dịch không thay đổi. Nhừ vậy, benzen không phản ứng với brom ở điều kiện thường. Cho tiếp một ít bột sắt vào ống nghiệm trên, lắc nhẹ. Màu của brom nhạt dần và thấy có khí hiđro bromua thoát ra do đã xảy ra phản ứng thế: brombenzen Nếu cho các ankylbenzen phản ứng với brom trong điều kiện có bột sắt sẽ thu được hỗn hợp sản phẩm thế brom chủ yếu vào vị trí para và ortho so với nhóm ankyl : Br 4-bromtoluen (p-bromtoluen) Phản ứng với axit nitric Cho benzen vào ống nghiệm chứa sẵn hỗn hợp H2SO4 đặc và HNO3 đặc. Lắc mạnh hỗn hợp khoảng 5-10 phút sau đó rót hỗn hợp vào cốc nước lạnh, dùng đũa thuỷ tinh khuấy đều. Khi đó sẽ thấy có lớp chất lỏng nặng màu vàng nhạt lắng xuống. Đó là nitrobenzen được tạo thành theo phản ứng : + HNO3 (đặc) H2SO4 đặc + H2O nitrobenzen Trong điều kiện trên, các ankylbenzen chủ yếu cho sản phẩm thế vào vị trí ortho và par a so với nhóm ankyl. 77ứ dụ : NO2 4-nitrotoluen (p-nitrotoluen) (58%) (42%) Quy tắc thế: Các ankylbenzen dễ tham gia phản ứng thế nguyên tử H của vòng benzen hơn benzen và sự thế ưu tiên ở vị trí ortho và par a so với nhóm ankyl. Thế nguyên tửH của mạch nhánh Nếu đun toluen hoặc các ankylbenzen với brom, sẽ xảy ra phản ứng thế nguyên tử H của mạch nhánh tương tự ankan. Thí dụ : toluen benzyl bromua Phản ứng cộng Cộng hiđro xiclohexan Cộng cỉo Dẫn một lượng nhỏ khí clo vào bình nón chứa một ít benzen, đậy kín lại rồi đưa bình ra ngoài ánh nắng. Trong bình xuất hiện khói trắng và trên thành bình thấy xuất hiện một lớp bột màu trắng. Đó là 1,2,3,4,5,6-hexacloxiclohexan, còn được gọi là hexacloran. hexacloran Trước kia, phản ứng này được dùng để sản xuất thuốc trừ sâu 666 nhưng do chất này có độc tính cao và phân huỷ chậm nên ngày nay không được sử dụng. Phản ứng oxi hoá Phản ứng oxi hoá không hoàn toàn Thí nghiệm : Tiến hành thí nghiệm như hình 7.2 1 ml benzen 1 ml toluen ị Lắc 1 ml dd KMnO4 benzen toluen dd KMnO4 1 ml dd 'KMnO4 dd KMnO4 Hình 7.2. Benzen và toluen không làm mất màu dung dịch KMnO4 ở điều kiện thường Khi đun nóng đồng thời cả hai ống nghiệm trong nồi cách thuỷ, ta thấy : - Benzen vẫn không làm mất màu dung dịch kali pemanganat. - Toluen làm mất màu dung dịch kali pemanganat, tạo kết tủa mangan đioxit: COOK + 2MnO2 + KOH + H2O toluen kali benzoat Tương tự toluen, các ankylbenzen khác cũng không làm mất màu dung dịch thuốc tím ở điều kiện thường nhưng làm mất màu dung dịch thuốc tím khi đun nóng. Phản ứng oxi hoá hoàn toàn Các hiđrocacbon thơm khi cháy toả nhiều nhiệt : CnH2n-6 + ^2^ °2 —-ỉ—> nCO2 + (n-3)H2O B - MỘT VÀI HIĐROCACBON THƠM KHAC I - STIREN Cấu tạo và tính chất vật lí Công thức phân tử : CgHg. H H I c- H Phân tử stiren có cấu tạo phảng. CH = CH2 hoặc Công thức cấu tạo : Stiren (còn gọi là vinylbenzen) là chất lỏng không màu, sôi ở 146°c, không tan trong nước nhưng tan nhiều trong dung môi hữu cơ. Tính chất hoá học Cấu tạo phân tử của stiren có đặc điểm giống etilen và có đặc điểm giống benzen, do đó có thể thấy rằng stiren vừa có tính chất giống anken vừa có tính chất giống benzen. Stiren có phản ứng cộng với Br2, H2, HBr, HI, ... vào liên kết đôi và làm mất màu dung dịch KMnO4 ở điều kiện thường. Phản ứng với dung dịch brom Phản ứng với hiđro Khi cho stiren tác dụng với hiđro dư có xúc tác ở nhiệt độ và áp suất cao sẽ thu được etylxiclohexan : etylbenzen CH9CH3 c) Phản ứng trùng họp etylxiclohexan Stiren cũng tham gia phản ứng thế nguyên tử H của vòng benzen. II - NAPHTALEN Cấu tậo và tính chất vật lí Công thức phân tử : C10H8 Phân tử naphtalen có cấu tạo phẳng. Công thức cấu tạo : Naphtalen (băng phiến) là chất rắn, nóng chảy ở 80°C, tan trong benzen, ete,... và có tính thăng hoa. Hình 7.3. Bông Naphtalen thăng hoa Tờ giấy có đục lỗ Naphtalen Thí nghiệm naphtalen thăng hoa 2. Tính chất hoá học Naphtalen có tính chất hoá học tương tự benzen. Phản ứng thế Naphtalen tham gia phản ứng thế tương tự benzen, nhưng phản ứng xảy ra dễ dàng hơn và thường ưu tiên thế vào vị trí số 1. Thí dụ : 1-nitronaphtalen b) Phản ứng cộng Khi có chất xúc tác, naphtalen cộng hiđro tạo ra đecalin : tetralin đecalin Naphtalen không làm mất màu dung dịch KMnO4 ở điều kiện thường. c - ÚNG DỤNG CỦA MỘT số HIĐROCACBON THƠM Benzen và tolưen là nguyên liệu rất quan trọng CỈ1O công nghiệp hoá học. Nguồn cung cấp benzen, toluen chủ yếu là từ nhựa than đá và từ sản phẩm đề hiđro đóng vòng hexan, heptan tương ứng. BÀI TẬP 1. 2. ứng với công thức phân tử C8H10 có bao nhiêu đồng phân hiđrocacbon thơm ? A. 2 B. 3 c. 4 D. 5 Toluen và benzen phản ứng được với chất nào sau đây : (1) dung dịch brom trong CCI4 ; (2) dung dịch kali pemanganat ; (3) hiđro có xúc tác Ni, đun nóng ; (4) Br2 có bột Fe, đun nóng ? Viết phương trình hoá học của các phản ứng xảy ra. Viết phương trình hoá học của các phản ứng xảy ra trong mỗi trường hợp sau : Toluen tác dụng với hiđro có xúc tác Ni, áp suất cao, đun nóng. Đun nóng benzen với hỗn hợp HNO3 đặc và H2SO4 đặc. Trình bày phương pháp hoá học phân biệt các chất : benzen, hex-1-en và toluen. Viết phương trình hoá học của các phản ứng đã dùng. Hiđrocacbon X là chất lỏng có tỉ khối hơi so với không khí bằng 3,17. Đốt cháy hoàn toàn X thu được co2 có khối lượng bằng 4,28 lần khối lượng H2O. Ở nhiệt độ thường, X không làm mất màu dung dịch brom. Khi đun nóng, X làm mất màu dung dịch KMnO4. Tìm công thức phân tử và viết công thức cấu tạo của X. Viết phương trình hoá học của phản ứng giữa X và H2 (xúc tác Ni, đun nóng), với brom (có mặt bột Fe), với hỗn hợp dư của axit HNO3 và axit H2SO4 đậm đặc. Đánh dấu cộng (+) vào ô cặp chất có phản ứng với nhau theo mẫu sau : benzen hexen toluen etilen H2, xúc tác Ni + + Br2 (dd) Br2 có Fe, đun nóng Dd KMnO4, đun nóng HBr H2O (xt H+) Cho benzen tác dụng với lượng dư HNO3 đặc có xúc tác H2SO4 đặc để điều chế nitrobenzen. Tính khối lượng nitrobenzen thu được khi dùng 1,00 tấn benzen với hiệu suất 78,0%. So sánh tính chất hoá học của etylbenzen với stiren, viết phương trình hoá học của các phản ứng để minh hoạ. Dùng công thức cấu tạo viết phương trình hoá học của phản ứng giữa stiren với : H2O (xúc tác H2SO4) HBr H2 (theo tỉ lệ sô' mol 1:1, xúc tác Ni) Trình bày phương pháp hoá học phân biệt 3 chất lỏng sau : toluen, benzen, stiren. Viết phương trình hoá học của các phản ứng đã dùng. Khi tách hiđro của 66,25 kg etylbenzen thu được 52,00 kg stiren. Tiến hành phản ứng trùng hợp toàn bộ lượng stiren này thu được hỗn hợp A gồm polistiren và phần stiren chưa tham gia phản ứng. Biết 5,20 gam A vừa đủ làm mất màu của 60,00 mi dung dịch brom 0,15M. Tính hiệu suất của phản ứng tách hiđro của etylbenzen. Tính khối lượng stiren đã trùng hợp. Polistiren có phân tử khối trung bình bằng 3.12.105. Tíhh hệ số trùng hợp trung bình của polime. Trình bày cách đơn giản để thu được naphtalen tinh khiết từ hỗn hợp naphtalen có lẫn tạp chất không tan trong nước và không bay hơi. Từ etilen và benzen, tổng hợp được stiren theo sơ đồ : C6H6 c6h5c2h5 c6h5-ch = ch2 Viết các phương trình hoá học thực hiện các biến đổi trên. Tính khối lượng stiren thu được từ 1,00 tấn benzen nếu hiệu suất của quá trình là 78%. Tư liệu CÔNG THỨC CẤU TẠO CỦA BENZEN ĐÃ ĐƯỢC TÌM RA NHƯ THẾ NÀO Năm 1865, Kê-ku-lê đề xuất công thức cấu tạo của benzen : c = c H - c C - H hay 1 Hz XH Theo công thức này, phân tứ benzen có 3 liên kết đôi xen kẽ với 3 liên kết đon. Như vậy, sáu liên kết trong phân tử benzen phải có độ dài khác nhau và benzen phải có tính chất hoá học giống anken (làm mất màu dung dịch brom, dung dịch kali pemanganat, ...). Tuy nhiên, thực nghiệm cho thấy benzen vừa thể hiện tính chất cúa một hiđrocacbon không no giống anken (phán ứng cộng H2 có mặt chất xúc tác Ni) vừa thế hiện tính chất của hiđrocacbon no (không làm mất màu dung dịch brom, có phản ứng thế) chứng tỏ công thức cấu tạo của Kê-ku-lê chưa phản ánh đúng cấu tạo thực của benzen. Các kết quá nghiên cứu sau đó đã xác định được benzen có cấu tạo phẳng, sáu cạnh đều và được biếu thị bằng công thức :