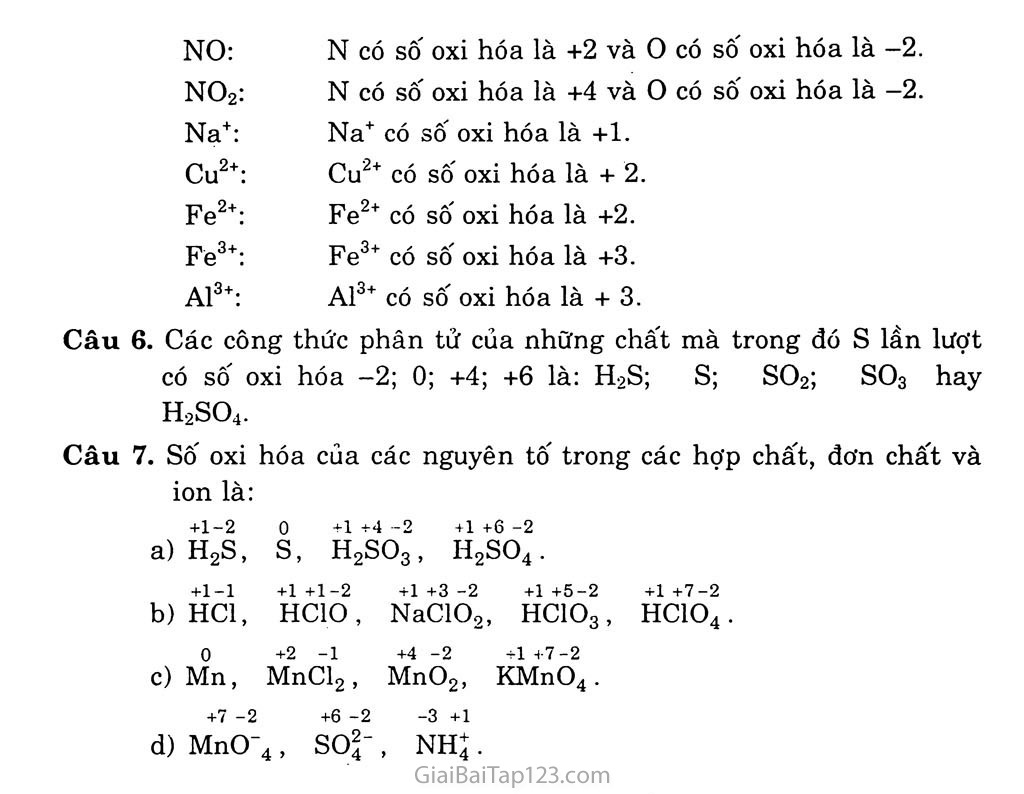Giải Hóa 10: Bài 15. Hóa trị và số oxi hóa
15ÀI15. HÓA TRỊ VÀ SỐ 0X1 HÓA A. KIẾN THỨC CẦN NHỚ HÓA TRỊ Hóa trị trong hỢp chất ion Trong các họp chất ion, hóa trị của một nguyên tố hằng điện tích của ion và được gọi là điện hóa trị của nguyên tố đó. Ví dụ: Trong NaCl, Na có điện hóa trị 1+ và C1 có điện hóa trị 1- Điện hóa trị của một nguyên tố đúng bằng số electron mà nguyên tử của nguyên tố nhường hoặc thu để tạo thành ion. Hóa trị trong họ'p chất cộng hóa trị Hóa trị của một nguyên tố trong hợp chất cộng hóa trị gọi là cộng hóa trị và hằng số liền kết cộng hóa trị mà nguyên tử của nguyên tố đó tạo ra được với các nguyên tử khác trong phân tử. Ví dụ: Trong phân tử NH3, nguyên tử nitơ có 3 liên kết cộng hóa trị và H có 1 liên kết cộng hóa trị —> N có cộng hóa trị 3 và H có cộng hóa trị 1. Trong phân tử H20 thì o có cộng hóa trị 2 và H có cộng hóa trị 1. SỐ 0X1 HÓA Khái niệm Số oxi hóa của một nguyên tố trong phân tử là điện tích của nguyên tử nguyên tố đó trong phân tử, nếu giả định rằng liên kết giữa các nguyên tử trong phân tử là liến kết ỉon. Quy tắc xác định Để xác định số oxi hóa , ta đưa ra một số quy tắc sau đây: Quy tắc 1: số oxi hóa của nguyên tố trong các đơn chất bằng 0. Thí dụ: số oxi hóa của nguyên tố Cu, Zn, H, N, o trong đơn chất Cu, Zn, H2, N2, 02... đều bằng 0. Quy tắc 2: Trong một phân tử, tổng số số oxi hóa của các nguyên tố bằng 0. Quy tắc 3: Số oxi hóa của các ion đơn nguyên tử bằng điện tích của ion đó. Trong ion đa nguyên tử, tổng số số oxi hóa của các nguyên tử bằng điện tích của ion đó. GBT Hóa 10 CB Quy tắc 4: Trong hầu hết các hợp chất, số oxi hóa của hiđro bằng +1, trừ hiđrua kim loại (NaH, CaH2...). Số oxi hóa của oxi bằng -2, trừ trường hợp OF2 và peoxit (chẳng hạn H2O2...). 77ú dụ 1: Số oxi hóa của các nguyên tố ở các ion K+, Ca2+, CT, s2“ lần lượt bằng +1, +2, -1, -2. Thí dụ 2: Tính số oxi hóa (x) của nito' trong amoniac NH3, axit nitrơ HNO2, và anion nitrat NO3. Trong NH3: X + 3(+l) = 0 => X = -3. Trong HNO2: (+1) + X + 2(-2) = 0 => X = +3 Trong NO3~: X + 3(-2) = -1 => X = + 5 Cách vỉêt sô oxi hóa: Sô oxi hóa được viết bằng chữ số thường, -3+1 dấu đặt trước và được đặt ở trên kí hiệu nguyên tố. Thí dụ: NH3 B. HƯỚNG DẪN GIẢI BÀI TẬP SGK TRANG 74 Câu 1. Chọn B Trong NH4+: X + 4(+l) = + 1 => X = -3 Trong NO2”: X + 2(-2) = -1 => X = +3 Trong HNO3: X + 3(-2) + l = 0=>x = +5 Câu 2. Chọn A Số oxi hóa của Mn (đơn chất) bằng 0. Số oxi hóa của Fe3+ bằng +3. Số oxi hóa của s trong SO3: X + 3(-2) = 0 => X = +6 Số oxi hóa của p trong PO4" : X + 4(~2) = -3 => X = +5 Câu 3. Điện hóa trị của các nguyên tố là: Cs = 1+; Cl = 1-; Na = 1+; Ba = 2+; o = 2-; AI = 3+. Câu 4. Cộng hóa trị của các nguyên tố là: Câu 5. Sô' oxi hóa của các nguyên tố là: CO2: c có số oxi hóa là +4 và o có số oxi hóa là -2. H2O: H có số oxi hóa là +1 và o có số oxi hóa là -2. so3: s có số oxi hóa là +6 và o có số oxi hóa là -2. NH3: N có số oxi hóa là -3 và H có số oxi hóa là +1. NO: N có số oxi hóa là +2 và 0 có số oxi hóa là -2. NO2: N có sô" oxi hóa là +4 và 0 có số oxi hóa là -2. Na+: Na+ có sô" oxi hóa là +1. Cu2+: Cu2+ có sô' oxi hóa là + 2. Fe2+: Fe2+ có sô" oxi hóa là +2. Fe3+: Fe3+ có sô" oxi hóa là +3. Al3+: Al3+ có sô" oxi hóa là + 3. Câu 6. Các công thức phân tử của những chất mà trong đó s lần lượt có số oxi hóa -2; 0; +4; +6 là: H2S; S; SO2; SO3 hay H2SO4. Câu 7. Sô" oxi hóa của các nguyên tố trong các hợp chất, đơn chất và ion là: +1-2 0 +1+4-2 +1+6-2 a) H2S, s, H2SO3, H2SO4. b) +1-1 HC1, +1 +1-2 HC1O, +1+3-2 +1+5-2 +1+7-2 NaClOo, HCÍOg, HC1O4 c) 0 Mn, +2 -1 MnCl2, +4 -2 +1 +7-2 MnO2, KMnO4. +7 -2 +6 -2 -3 +1 d) MnO 4, SO2-, , nh;.