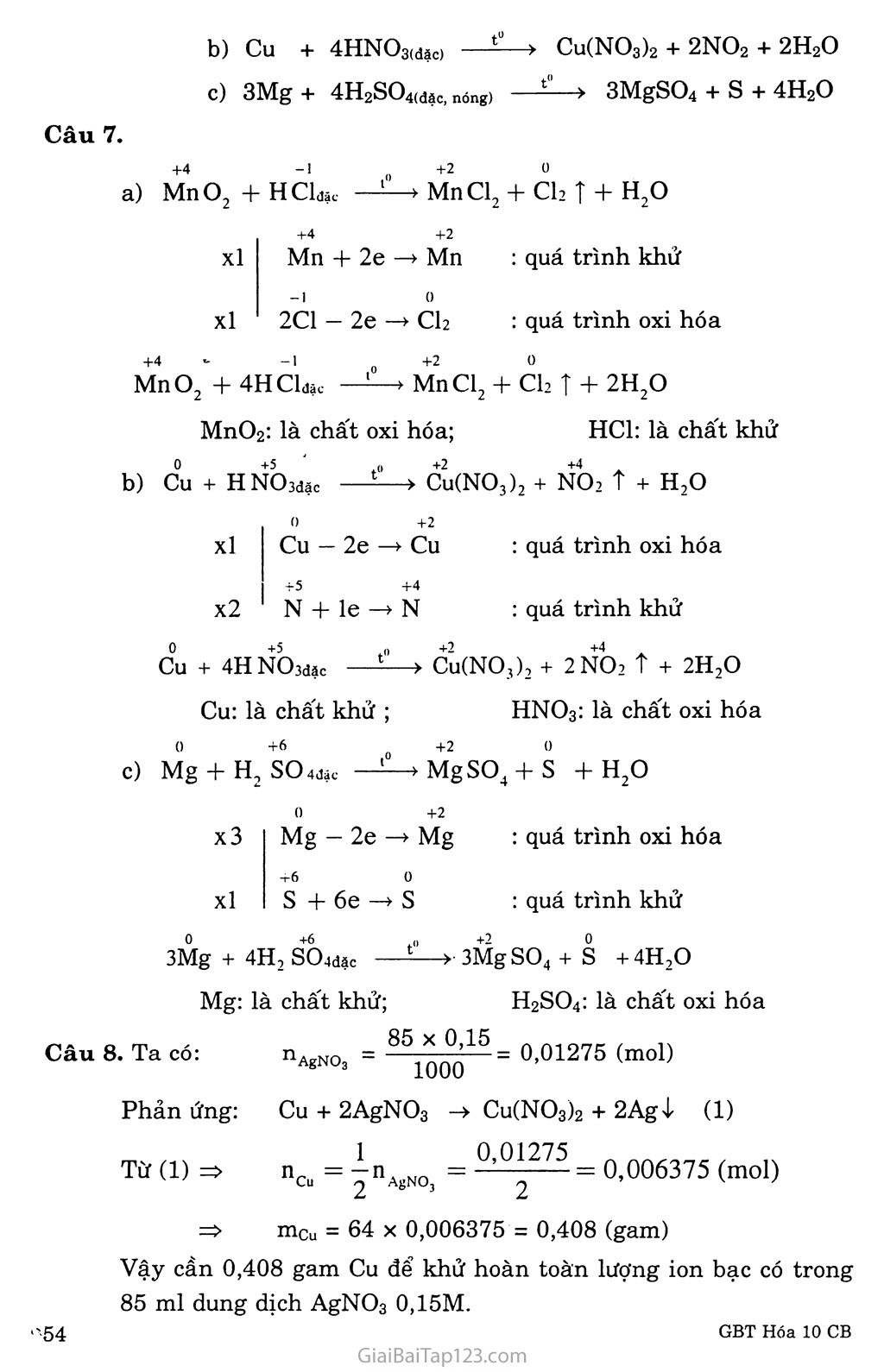Giải Hóa 10: Bài 17. Phản ứng oxi hóa - khử
BÀI 17. PHẢN ỨNG OXi HÓA - KHỬ A. KIẾN THỨC CẦN NHỚ ĐỊNH NGHĨA Phản ứng oxi hóa - khử là phản ứng hóa học, trong đó có sự chuyển electron giữa các chất phản ứng; hay phản ứng oxi hóa - khử là phản ứng hóa học trong đó có sự thay đổi số oxi hóa của một số nguyên tố. Xét phản ứng oxi hóa - khử sau: 2e Cu + 2H2SO4(đặc) —Cu so4 + SO2 + 2H2O Chất khử (hay chất bị oxi hóa) là chất nhường electron: Cu Chất oxi hóa (hay chất bị khử) là chất thu electron: H2SO4 Quá trình oxi hóa (sự oxi hóa) là quá trình nhường electron: 0 +2 Cu - 2e -» Cu Quá trình khử (sự khử) là quá trình thu electron: +6 +4 s + 2e -> s Chú ỷ: Sự nhường electron chỉ có thể xảy ra khi có sự nhận electron. Vì vậy, sự oxi hóa và sự khử bao giờ củng diễn ra đồng thời trong một phản ứng oxi hóa - khử. Trong phản ứng oxi hóa - khử bao giờ cũng có chất oxi hóa và cliất khử tham gia. LẬP PHƯƠNG TRÌNH HÓA HỌC CỦA PHẢN ỨNG OXI HÓA - KHỬ Cân bằng phản ứng oxi hóa - khử theo phương pháp thăng bằng electron. Phương pháp này dựa trên nguyên tắc: Tổng số electron do chất khử nhường phải đúng bằng tổng số electron mà chất oxi hóa nhận. Gồm các bước sau: Thí dụ: Lập phương trình hóa học của phản ứng p cháy trong 02 tạo ra P2O5 theo so' đồ phản ứng: p + 02 -> P2O5 Bước 1: Xác định số oxi hóa của các nguyên tố trong phản ứng để tìm chất oxi hóa và chất khử: Số oxi hóa của p tăng từ 0 đến +5: p là chất khử: Số oxi hóa của oxi giảm từ 0 đến -2: 02 là chất oxi hóa. Bước 2: Viết quá trình oxi hóa và quá trình khử, cân bằng mỗi quá trình: ° ’5 p - 5e _> p (quá trình oxi hóa) Ơ2 + 4e -> 2 o (quá trình khử) Bước 3: Tìm hệ số thích hợp cho chất oxi hóa và chất khử sao cho tổng số electron do chất khử nhường bằng tổng số electron mà chất oxi hóa nhận: 0 .5 X 4 P - 5e -> P 0 -2 X 5 O2 + 4e -> 2 0 Bước 4: Đặt hệ số của chất oxi hóa và chất khử vào sơ đồ phản ứng, từ đó tính ra hệ số của các chất có mặt trong phương trình hóa học, kiểm tra cân bằng số nguyên tử của các nguyên tố và cân bằng điện tích hai vế để hoàn tất việc lập phương trình hóa học của phản ứng: 4P + 5O2 -> 2P2O5 Ý NGHĨA CỦA PHẢN ỨNG OXI HÓA - KHỬ Trong đời sông, phần lớn năng lượng ta dùng là năng lượng của phản ứng oxi hóa - khử. Sự cháy của xăng dầu trong các động cơ đốt trong, sử cháy của than, củi, các quá trình điện phân, các phản ứng xảy ra trong pin, ăcquy... đều là quá trình oxi hóa - khử. Trong sản xuất, nhiều phản ứng oxi hóa - khử là cơ sở của quá trình sản xuất hóa học như luyện gang, thép, luyện nhôm, sản xuất các hóa chất cơ bản như xút, axit clohiđric, axit nitric, sản xuất phân bón, thuốc bảo vệ thực vật, dược phẩm, v.v... B. HƯỚNG DẪN GIẢI BÀI TẬP SGK TRANG 82 - 83 Câu 1. Chọn A Phán ứng oxi hóa - khứ là phản ứng hóa học trong đó có sự thay đổi số oxi hóa của một sô" nguyên tố: 2I-Ígổ———>2Hg + Ỏ2 Câu 2. Chọn D Câu 3. Chọn c 2I-1NO, + 3H2ẳ 3S + 2NO T + 4H2O Câu 4. Chọn c N+ 2e -> N : quá trình khử Vậy NOa vừa là chất oxi hóa, vừa là chất khử. Câu 5. Chất oxi hóa là chát thu electron nên sau phản ứng sô" oxi hóa giam ° rì (O2 -> 0) 0 0 -1 -2 Thí dụ: 4Na +022 Na2 o Sự oxi hóa là sự nhường electron 0 ' +1 Thí dụ: 2Na - 2e -> 2 Na : sự oxi hóa Chất khử là chất nhường electron nên sau phản ứng số oxi 0 +1 hóa tăng: (Na -> Na) Sự khử là sự thu electron. Thí dụ: 02 + 4e —> 2Õ : sự khử. Câu 6. Phản ứng oxi hóa - khử là phản ứng hóa học trong đó có sự thay dổi số oxi hóa của một số nguyên tố. Thí dụ: a) MnƠ2 + 4HC1 —> MnCl2 + CI2+ 2H2O xl +4 Mn + 2e +2 -4 Mn : quá trình khử xl 2C1 - 2e - -+CI2 : quá trình oxi hóa -1 +2 0 + 4HClđặc — -> MnCl2 + CI2 T + 2H2o Câu 7. i—> Cu(NO3)2 + 2NO2 + 2H2O c) 3Mg + 4H2SO4(đặc, nóng) ——> 3MgSO4 + s + 4H2O b) Cu + 4HNO3(đãc) +4 -1 0 +2 0 a) MnO, + HClđậc —í—> MnCl2 + Ch T + H2O MnO2: là chất oxi hóa; HC1: là chất khử b) c°u + HNốdđặc —Cu(NO3)2 + NƠ2 t + H2O xl x2 0 +2 Cu — 2e —> Cu +5 +4 N + le -> N quá trình oxi hóa quá trình khử c°u + 4HNÒ3dặc —Cu(NO,)2 + 2NO2 t + 2H2O Cu: là chất khử ; HNO3: là chất oxi hóa c) Mg + H2 "so 4đậc —MgSO4 + S + H2O 0 +2 x3 Mg - 2e —* Mg +6 0 xl s + 6e —> s quá trình oxi hóa : quá trình khử »3MgSO4+S +4H2O Mg: là chất khử; H2SO4: là chất oxi hóa 85 X 0,15 3Mg + 4H2 SChđặc Câu 8. Ta có: AgNOa 1000 - = 0,01275 (mol) Phản ứng: Cu + 2AgNO3 -> Cu(NO3)2 + 2Agị (1) Từ (1) => nc„ = 1 nAíNOi = = 0,006375 (mol) => mcu = 64 X 0,006375 = 0,408 (gam) Vậy cần 0,408 gam Cu để khử hoàn toàn lượng ion bạc có trong 85 ml dung dịch AgNO3 0,15M.