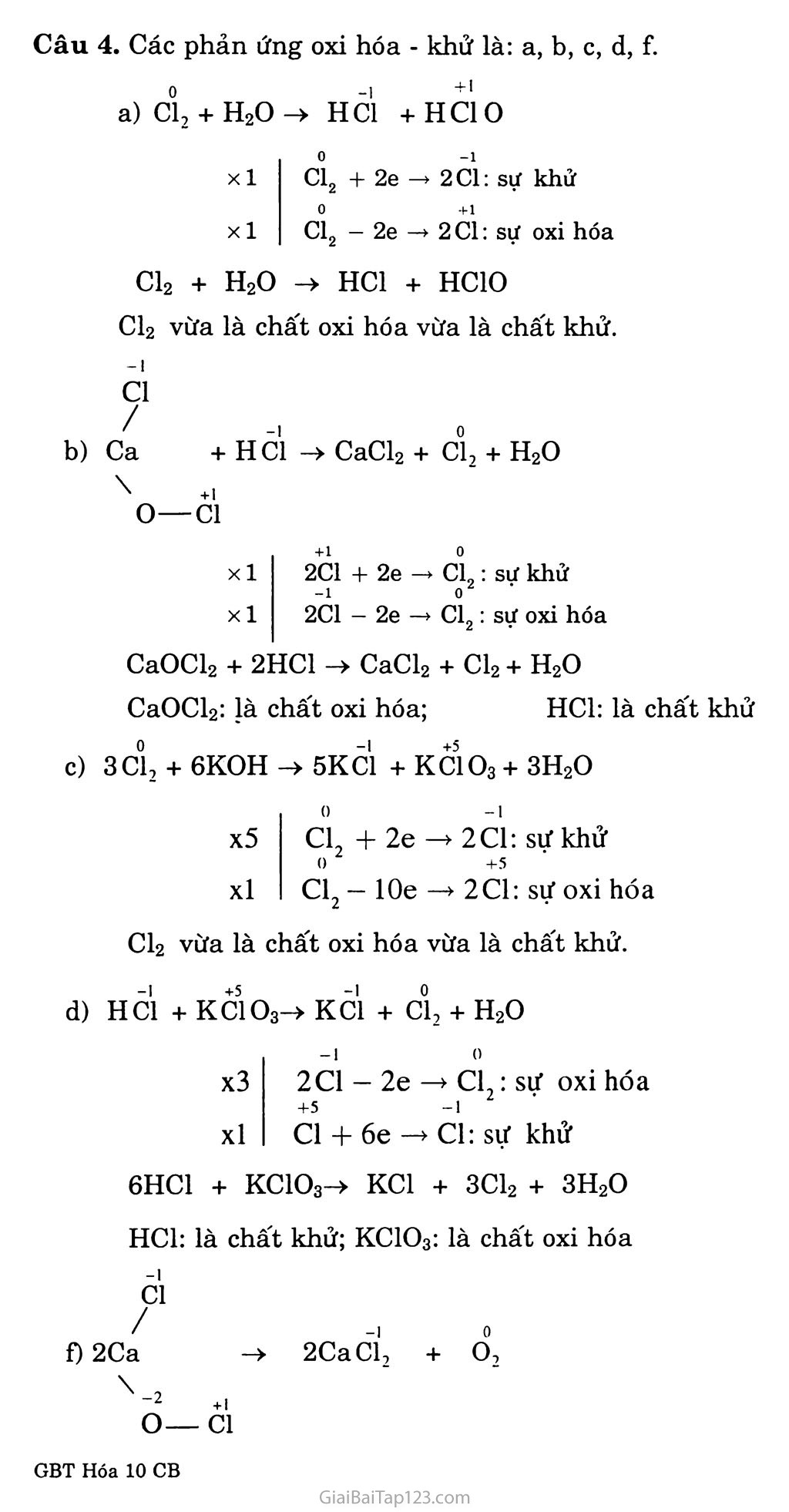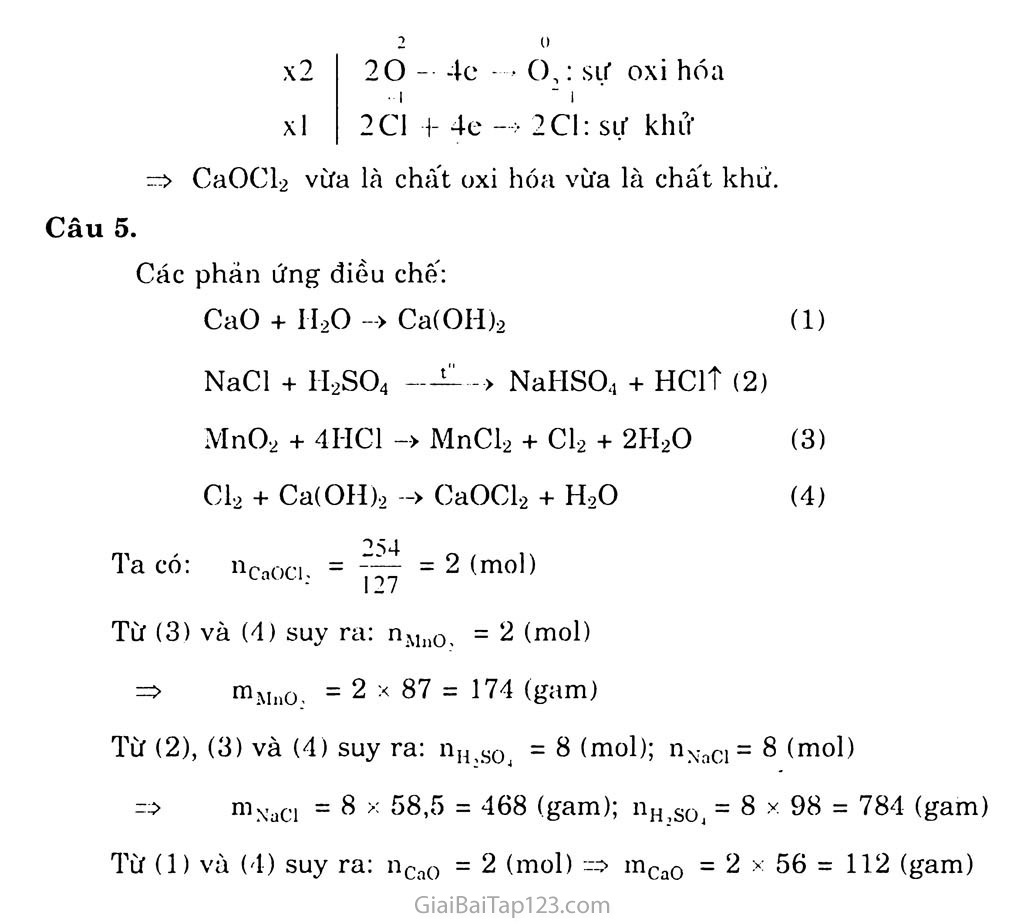Giải Hóa 10: Bài 23. Sơ lược về hợp chất có oxi của clo
BÀI 23. Sơ LƯỢC VỀ HỢP CHẤT có OXI CỦA CLO A. KIẾN THỨC CẦN NHỚ NƯỚC GIA-VEN Chúng ta đã biết khí clo tác dụng với dung dịch NaOH loãng nguội tạo thành dung dịch hỗn hợp natri clorua và natri hipoclorit, đó là nước Gia-ven (Javel). 2NaOH + cì2 NaCl + NaClO + H2O (natriclorua) (natri hipoclorit) ' V : ' Nước Gia-vcn NaClO là muối của một axit rất yếu, natri hipoclorit trong nước Gia-ven dễ tác dụng với cacbon đioxit của không khí tạo thành axit hipoclorơ. NaClO + co2 + H2O -> NaHCOs + HC1O Do có tính oxi hóa mạnh, axit hipocloro- có tác dụng sát trùng, tẩy trắng sợi, vải, giấy. CLORUA VÔI Khi cho khí clo tác dụng với vôi tôi hoặc sữa vôi ở 30°C, ta thu được clorua vôi: Ca(OH)2 + Cl2 ->CaOCl2 + H2O cloruavôi -1 ^C1 Công thức cấu tạo của clorua vôi là: Ca^ - Ốl Clorua vôi là chất bột màu trắng, tác dụng với axit HC1 giải phóng khí clo: CaOCl2 + 2HC1 -> CaCl2 + Cl2t + H2O Trong không khí ẩm, clorua vôi tác dụng vói cacbon đioxit, giải phóng axit hipoclorơ: 2CaOCl2 + co2 + H2O -> CaCO3 + CaCl2 + 2HC10 So với nước Gia-ven, clorua vôi rẻ tiền hơn, có hàm lượng hipoclorit cao hơn, dễ bảo quản và dễ chuyên chở hơn. Clorua vôi cũng được dùng để tẩy trắng sợi, vải, giấy, để tẩy uế các hô" rác, và tinh chế dầu mỏ. B. HƯỚNG DẪN GIẢI BÀI TẬP SGK TRANG 108 Câu 1. Chọn B Câu 2. Tính chất hóa học chính của nước Gia-ven và clorua vôi là tính oxi hóa mạnh của muôi hipoclorit (NaCIO) cụ thể là muối +1 natri, tính oxi hóa của C1. Chú ý: Kliông nên giải thích là các chất trên không bền, dễ phân hủy tạo thành oxi nguyên tử và oxi nguyên tử có tính oxi hóa mạnh là nguyền nhân tính oxi hóa mạnh của HCIO và NaClO. Úng dụng của nước Gia-ven: Dùng để sát trùng, tẩy trắng sợi, vải, giấy.... Dùng để tẩy uế chuồng trại, nhà vệ sinh,.... ứng dụng của clorua vôi: tương tự như nước Gia-ven, ngoài ra clorua vôi dùng trong việc tinh chế dầu mỏ, xử lí chất độc, bảo vệ môi trường. Câu 3. Điều chế axit HC1 từ NaCl, H2SO4 đặc, H2O: NaCl + H2SO4 —-—> NaHSO4 + HClt Hấp thụ khí hiđro clorua vào nước được dung dịch axit HC1. Từ HC1 và MnO2 điều chế Cl2: MnO2 + 4HC1 -> MnCls + Cl2 + 2H2O Từ Cl2 và dung dịch NaOH điều chế nước Gia-ven: Cl2 + 2NaOH -> NaCl + NaClO + H2O 74 Câu 4. Các phản ứng oxi hóa - khử là: a, b, c, d, f. a) ci2 + H2O-> Hỏi +HC1O xl xl 0 -1 Cl2 + 2e —> 2C1: sự khử 0 +1 Cl2 - 2e —> 2C1: sự oxi hóa -I C1 / b) Ca \ o- Cl2 + H2O -> HC1 + HC1O Cl2 vừa là chất oxi hóa vừa là chất khử. + Hỏi -> CaCl2 + cì2 + H2O +1 -C1 xl xl +1 0 2C1 + 2e —» Cl,: sự khử -1 o2 2C1 - 2e —> Cl2: sự oxi hóa CaOCl2 + 2HC1 -> CaCl2 + Cl2 + H2O CaOCl2: Ịà chất oxi hóa; HC1: là chất khử c) 3CÌ2 + 6KOH -> 5KC1 + KCIO3 + 3H2O x5 xl 0 -I Cl + 2e —> 2C1: sự khử 0 +5 CL *2 lOe —> 2C1: sự oxi hóa Cl2 vừa là chất oxi hóa vừa là chất khử. d) HC1 + KC103-> KC1 + cì2 + H2O -I x3 xl 20 - 2e —> C1 : sự oxi hóa +5 -1 C1 + 6e -> Cl: sự khử 6HC1 + KC103^ KC1 + 3C12 + 3H2O HC1: là chất khử; KC103: là chất oxi hóa -1 C1 í) 2Ca \ 2CaCÌ2 + Ổ2 -2 O- +1 C1 x2 20 — 4c —* o,: sự oxi hóa xl -I I xl 2Cl + 4e -> 2Cl: sự khử => CaOCl2 vừa là chất oxi hóa vừa là chất khử. Câu 5. Các phản ứng điều chế: CaO + II2O -> Ca(OH)2 (3) (4) NaCl + 1I2SO4 > NaHSO.1 + HClt (2) MnO2 + 4I-IC1 -> MnCl2 + Cl2 + 2H2O Cl2 + Ca(OH)2 -> CaOCl-2 + H20 4 a có: nCa0C| - 2 (mol) Từ (3) và (4) suy ra: nMn0, = 2 (mol) => mMno_, = 2 X 87 = 174 (gam) Từ (2), (3) và (4) suy ra: nH,so4 = 8 (mol); nNaC1 = 8 (mol) => mNaCi = 8 X 58,5 = 468 (gam); nH2gOj - 8 X 98 = 784 (gam) Từ (1) và (4) suy ra: nCa0 = 2 (moi) => mCa0 = 2 X 56 = 112 (gam)