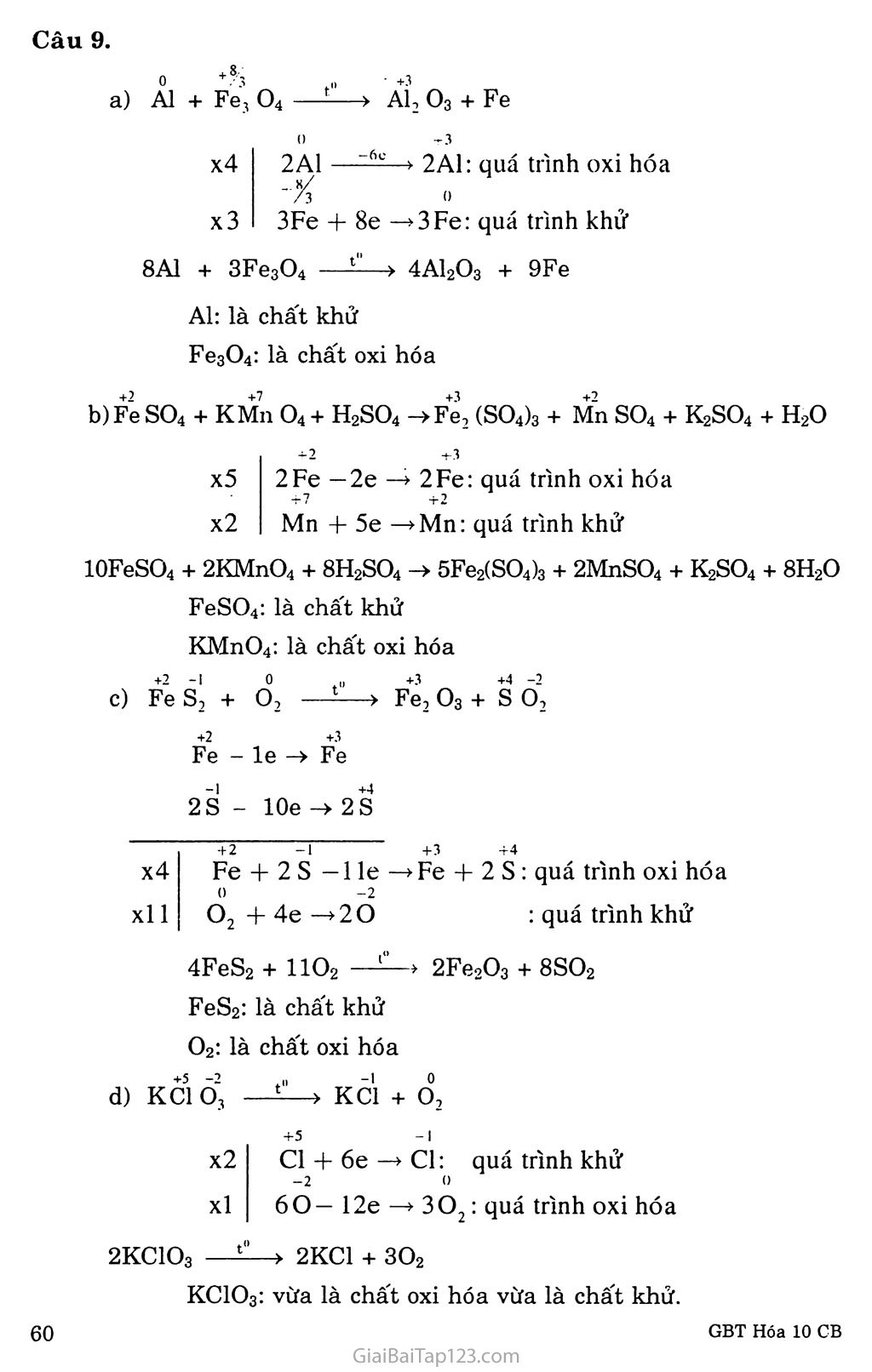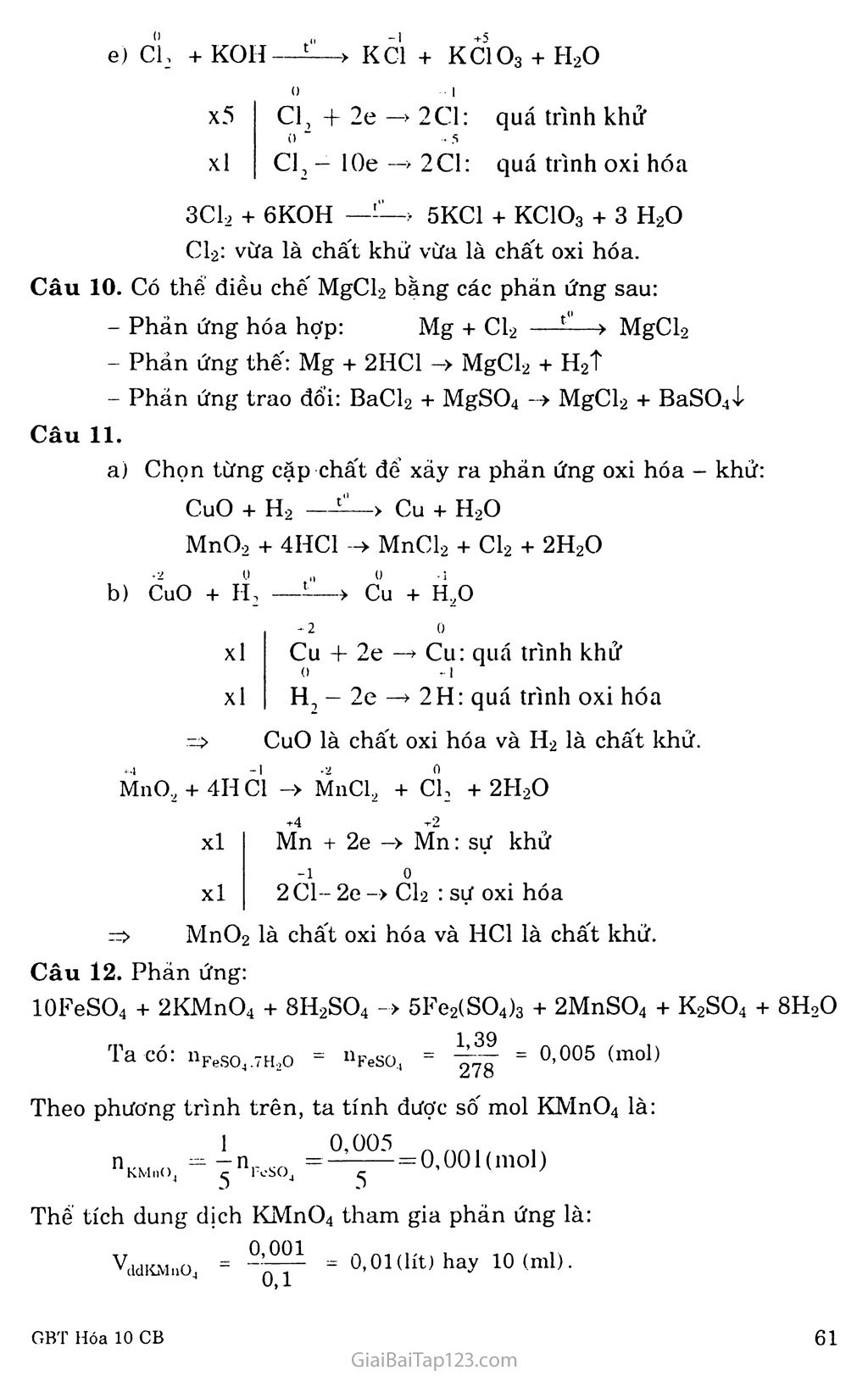Giải Hóa 10: Bài 19. Luyện tập: Phản ứng oxi hóa - khử
BÀI 19. LUYỆN TẬP: PHẢN ỨNG OXI HÓA - KHỬ HƯỚNG DẪN GIẢI BÀI TẬP SGK TRANG 88 - 89 - 90 Câu 1. Chọn D Câu 2. Chọn c Câu 3. Chọn D Phản ứng được cân bằng như sau: 3M, Ox + (24 - 2x) HNOs -> 6M(NO3)3 + (6 - 2x)íỉ o + (12 - x)H20 • Để phản ứng trên là phản ứng oxi hóa - khử thì: 6 - 2x 0 X £ 3 o Để phản ứng trên không là phản ứng oxi hóa - khử thì: 6 - 2x - 0 X — 3 Câu 4. Câu đúng a, c; Câu sai: b, d Câu 5. - Số oxi hóa của nito' trong các hợp chất: NH4CI; NO; N 02 ; N2 05 ; HN 03 ; HN 02 ; N Hs - Số oxi hóa của clo trong các hợp chất: HC1 ; HC10 ; HC1O2; HClOg ; HCIO4 / Ca \ -1 C1 +1 o — C1 Số oxi hóa của mangan trong hợp chất: Mn 02 ; KMn 04 ; K2Mn O4 ; Mn so4. Số oxi hóa của crom trong các hợp chất: K2Cr2 07 ; Cr2 (SO4)3 ; Cr2 03. Sô" oxi hóa của lưu huỳnh trong các hợp chất: H2S ; so2; H2 s 03 ; H2 s O4 ; Fe S ;FeS2. Câu 6. (trong AgNO3). (trong CuSCh). (trong H2O). Sự oxi hóa của Cu và sự khử Ag +2 +1 Sự oxi hóa của Fe và sự khử Cu Câu 7. Sự oxi hóa của Na và sự khử H Chất oxi hóa 02, chất khử là H2. Chất oxi hóaN , chất khử lào (đều trong phân tử KNO3) +3 ...... -3 _ Chất oxi hóaN , chất khử làN (đều trong phân tử NH4NO9) +3 Chất oxi hóaFe(trong Fe2O3) và chất khử là Al. Câu 8. Cl2 + 2HBr -> 2HC1 + B°r2 Cl2 ———> 2 C1: quá trình khử => Cl2 là chất oxi hóa. 2Br ———> Br2 : quá trình oxi hóa => HBr là chất khử. Tương tự: Cu là chất khử và H2SO4 là chất oxi hóa. HNO3 là chất oxi hóa và H2S là chất khử. FeCl2 là chất khử và Cl2 là chất oxì hóa. Câu 9. .°. ~ 'Á* „ a) ẢI + Fe, 04 —í—> AĨ2 Og + Fe x4 x3 0 2A1 .8/ —6e 2A1: quá trình oxi hóa /3 0 3Fe + 8e 3 Fe: quá trình khử -> 4A12O3 + 9Fe 8A1 + 3Fe3O4 — Al: là chất khử Fe3O4: là chất oxi hóa b)Fe so4 + KMn 04 + H2SO4 ->Fe, (SO4)g + Mil so4 + K2SO4 + H2O +2 +3 2Fe — 2e —> 2Fe: quá trình oxi hóa +7 +2 Mn 4- 5e —*Mn: quá trình khử x5 x2 10FeSO4 + 2KMnO4 + 8H2SO4 -> 5Fe2(SO4)3 + 2MnSO4 + K2SO4 + 8H2O FeSO4: là chất khử KMnO4: là chất oxi hóa c) Fe S2 + ố2 —í—> Fe2 03 + s 02 +2 Fe - le +3 Fe 2S - lOe +4 2S x4 xll 4-2 — 1 4" 3 4-4 Fe + 2 s — 1 le —>Fe + 2 s : quá trình oxi hóa ° ~2 : quá trình khử 02 4- 4e —>20 4FeS2 + 1102 — 2Fe2O3 + 8SO-2 FeS2: là chất khử 02: là chất oxi hóa d) KC1 Oj —^-> KC1 + 02 x2 xl 2KCIO3 +5 -I Cl 4- 6e —+ Cl: quá trình khử -2 0 60 — 12e —> 3O2: quá trình oxi hóa -> 2KC1 + 3O2 KC1O3: vừa là chất oxi hóa vừa là chất khử. e) Cl, + KOH—KC1 + KClOg + H2O () I x5 Cl, +2e—>2C1: quá trình khử 0 - -r 5 xl Cl, - lOe —2C1: quá trình oxi hóa 3C12 + 6KOH ——> 5KC1 + KClOg + 3 H2O Cl2: vừa là chất khử vừa là chất oxi hóa. Câu 10. Có thế điều chế MgCl2 bằng các phản ứng sau: Phản ứng hóa hợp: Mg + Cl2 ———> MgCl-2 Phản ứng thế: Mg + 2HC1 —> MgCl2 + H2t Phản ứng trao đối: BaCl2 + MgSO4 -> MgCl-2 + BaSO4ị Câu 11. Chọn từng cặp chất để xảy ra phản ứng oxi hóa - khử: CuO + H2 —> Cu + H20 MnOọ + 4HC1 -> MnCl2 + Cl2 + 2H2O CuO + II, —1—> Cu + H,0 +2 0 Cu + 2e —> Cu: quá trình khử 0+1 H, - 2e —> 2H: quá trình oxi hóa xl xl => CuO là chất oxi hóa và H2 là chất khử. MnO, + 4H Cl -> MnCl2 + ci, + 2H2O +4 +2 xl Mn + 2e —> Mn: sự khử -1 0 xl 2 Cl- 2e -> Cl2 : sự oxi hóa => MnO2 là chất oxi hóa và HC1 là chất khử. Câu 12. Phản ứng: 10FeSO4 + 2KMnO4 + 8H2SO4 -> 5Fe2(SO4)3 + 2MnSO4 + K2SO4 + 8H2O 1,39 Ta có: nFeso4.7H2o - nFeSOi 278 = 0,005 (mol) Theo phương trình trên, ta tính được số mol KMnO4 là: in - 0.005 5 npeSOj nKMnO, ^0,001(mol) Thế tích dung dịch KMnO4 tham gia phản ứng là: 0,001 ddKMilOj 0,1 = 0,01 (lít) hay 10 (ml).