Giải Hóa 10: Bài 9. Sự biến đổi tuần hoàn tính chất các nguyên tố hóa học. Định luật tuần hoàn
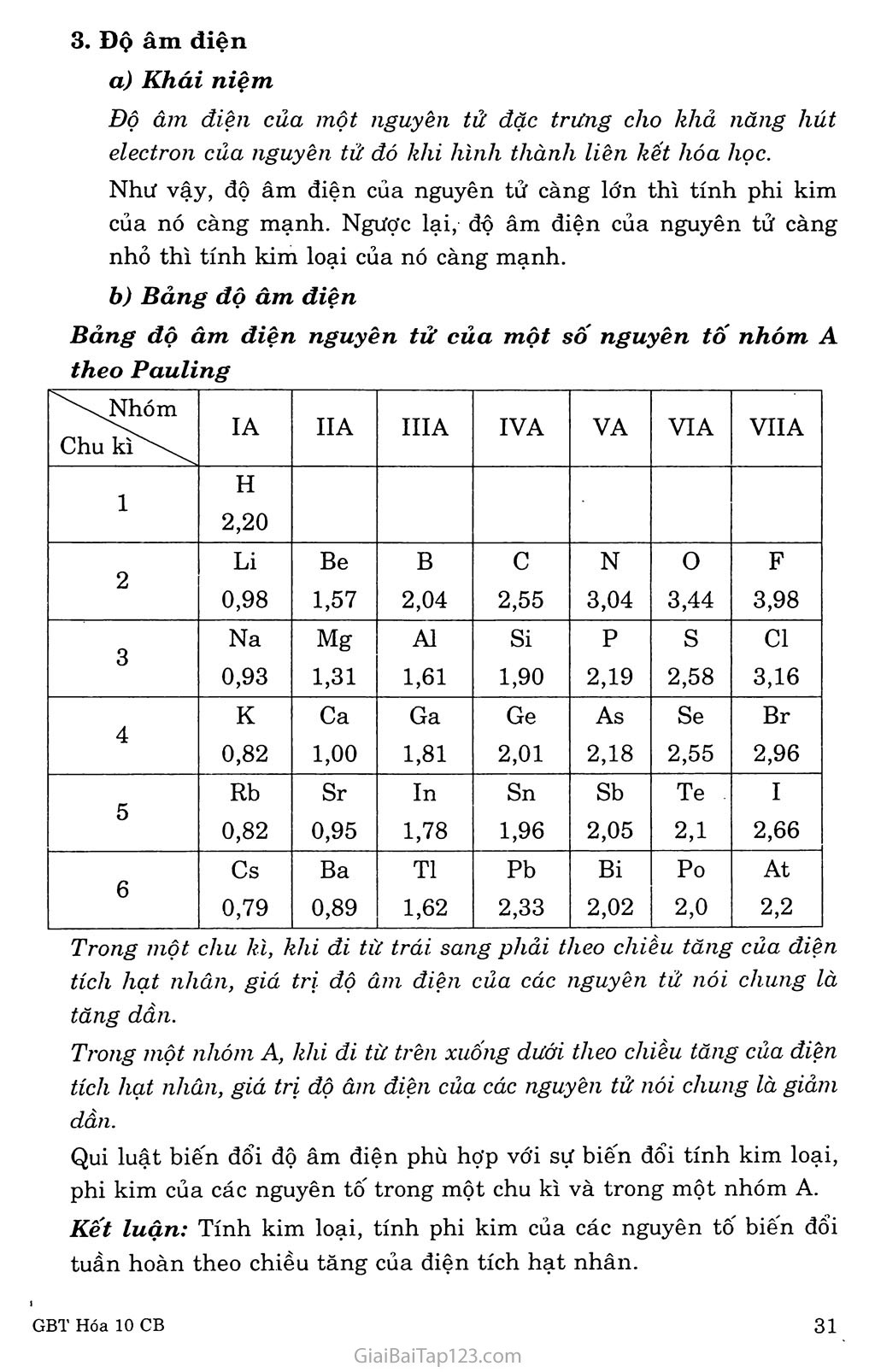
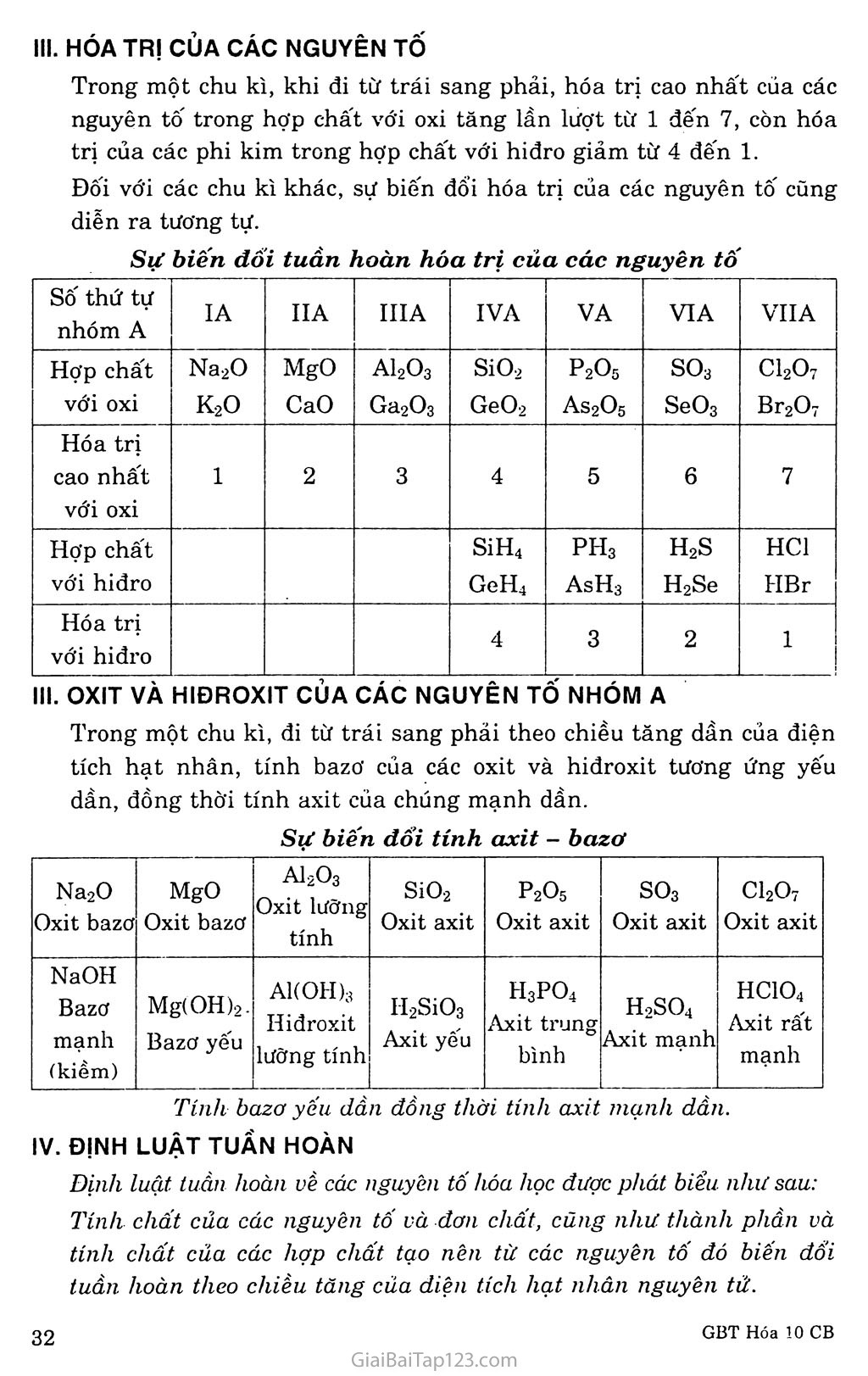
BÀI 9. Sự BIỂN ĐỔI TUẦN HOÀN TÍNH CHẤT CỦA CÁC NGUYÊN TỐ HÓA HỌC. ĐỊNH LUẬT TUẦN HOÀN A. KIẾN THỨC CẦN NHỚ TÍNH KIM LOẠI, TÍNH PHI KIM Tính kim loại là tính chát của một nguyên tố mà nguyên tử của nó dễ mất electron đế’ trỏ' thành ion dương. Nguyên tử càng dễ mất electron, tính kim loại của nguyên tố càng mạnh. Tính phi kim là tính chất của một nguyên tô" mà nguyên tử của nó dễ thu electron đế trỏ' thành ion âm. Nguyên tử càng dễ thu electron thì tính phi kim của nguyên tố càng mạnh. Ranh giới tương đối giữa nguyên tố kim loại, phi kim trong bảng tuần hoàn các nguyên tố hóa học được phân cách bằng đường dích dắc in đậm. Phía phải là nguyên tố phi kim, plĩía trái là nguyên tố kim loại. Sự biến đổi tính chất trong một chu kì Trong một chu kỉ, theo clilều tăng dần của điện tích hạt nhân, tính kim loại của các nguyên tố yếu dần, dồng thời tính phi kim mạnh dần. Có thể giải thích quy luật biến đổi tính chất trên theo bán kínli nguyên tử. Sự biến đổi tính chât trong một nhóm A Trong một nhóm A, theo chiều tăng của điện tích hạt nhân, tính kim loại của các nguyên tố mạnh dần, đồng thời tính phi kim yếu dần. Qui luật đó dược lặp lại đối với các nhóm A khác và được giải thích dựa vào bán kính nguyền tử. Độ âm điện Khải niệm Độ âm điện của một nguyên tử đặc trưng cho khả năng hút electron của nguyên tử đó khi hình thành liên kết hóa học. Như vậy, độ âm điện của nguyên tử càng lớn thì tính phi kim của nó càng mạnh. Ngược lại, độ âm điện của nguyên tử càng nhỏ thì tính kim loại của nó càng mạnh. Bảng độ âm điện Bảng độ ăm điện nguyên tử của một số nguyên tố nhóm A theo Pauling Nhóm Chu kìx'x\ IA IIA IIIA IVA VA VIA VIIA 1 H 2,20 2 Li 0,98 Be 1,57 B 2,04 c 2,55 N 3,04 0 3,44 F 3,98 3 Na 0,93 Mg 1,31 AI 1,61 Si 1,90 p 2,19 S 2,58 Cl 3,16 4 K 0,82 Ca 1,00 Ga 1,81 Ge 2,01 As 2,18 Se 2,55 Br 2,96 5 Rb 0,82 Sr 0,95 In 1,78 Sn 1,96 Sb 2,05 Te 2,1 I 2,66 6 Cs 0,79 Ba 0,89 TI 1,62 Pb 2,33 Bi 2,02 Po 2,0 At 2,2 Trong một chu kì, khi đi từ trái sang phải theo chiều tăng của điện tích hạt nhân, giá trị độ âm điện của các nguyên tử nói chung là tăng dần. Trong một nhóm A, khi đi từ trên xuống dưới theo chiều tăng của điện tích hạt nhân, giá trị độ âm điện của các nguyên tử nói chung là giảm dần. Qui luật biến đổi độ âm điện phù hợp với sự biến đổi tính kim loại, phi kim của các nguyên tô' trong một chu kì và trong một nhóm A. Kêt luận: Tính kim loại, tính phi kim của các nguyên tố biến đổi tuần hoàn theo chiều tăng của điện tích hạt nhân. HÓA TRỊ CỦA CÁC NGUYÊN Tố Trong một chu kì, khi đi từ trái sang phải, hóa trị cao nhất của các nguyên tố trong hợp chất với oxi tăng lần lượt từ 1 đến 7, còn hóa trị của các phi kim trong hợp chất với hiđro giảm từ 4 đến 1. Đối với các chu kì khác, sự biến đổi hóa trị của các nguyên tố cũng diễn ra tương tự. Sự biến dổi tuần hoàn hóa trị của các nguyên tố SỐ thứ tự nhóm A IA IIA IIIA IVA VA VIA VUA Hợp chất với oxi Na2O K2O MgO CaO A12O3 Ga2O3 SiO2 GeO-2 P2O5 As2Ơ5 so3 SeO3 C12O7 Br2O7 Hóa trị cao nhất với oxi 1 2 3 4 5 6 7 Hợp chất với hiđro S1H4 GeH4 PI-I3 AsH3 H2S H2Se HC1 HBr Hóa trị với hiđro 4 3 2 1 III. OXIT VÀ HIĐROXIT CỦA CÁC NGUYÊN Tố NHÓM A Trong một chu kì, đi từ trái sang phải theo chiều tăng dần của điện tích hạt nhân, tính bazơ của các oxit và hiđroxit tương ứng yếu dần, đồng thời tính axit của chúng mạnh dần. Sự biến đổi tính axit - bazơ Na2O Oxit bazơ MgO Oxit bazơ A12O3 Oxit lưỡng tính SiO2 Oxit axit P2O5 Oxit axit so3 Oxit axit C12O7 Oxit axit NaOH Bazơ mạnh (kiềm) Mg( OH)2. Bazơ yếu A1(OH);Ì Hiđroxit lưỡng tính II2SÌO3 Axit yếu H3PO4 Axit trung bình H2SO4 Axit mạnh HC1O4 Axit rất mạnh Tính bazơ yểu dần dồng thời tính axit mạnh dần. ĐỊNH LUẬT TUẦN HOÀN Định luật tuần hoàn về các nguyên tố hóa học được phát biểu như sau: Tính chất của các nguyên tố và đơn chất, củng như thành phần và tính chất của các hợp chất tạo nên từ các nguyên tố đó biến dổi tuần hoàn theo chiểu tăng của diện tích hạt nhân nguyên tử. B. IIƯỚNG DẪN GIẢI GIẢI BÀI TẬP SGK TRANG 47 - 48 Câu 1. Chọn D Câu 2. Chọn A Câu 3. Những tính chất sau đây biến đổi tuần hoàn: Hóa trị cao nhất với oxi. Số electron lớp ngoài cùng. Câu 4. Chọn A Câu 5. Chọn A Câu 6. Từ công thức RO2 cho ta hóa trị của R đôi với oxi là IV => R thuộc nhóm IVA. Vậy R là nguyên tố cacbon. Chọn c Câu 7. Chọn c Câu 8. Cấu hình electron của nguyên tử magie (Z = 12) là: ls2 2s2 2p6 3s2 . Để đạt được cấu hình electron của khí hiếm gần nhất trong bảng tuần hoàn, nguyên tử magie nhường 2 electron. Magie thể hiện tính kim loại. Câu 9. Cấu hình electron của nguyên tử lưu huỳnh s (Z = 16) là: ls2 2s2 2p6 3s2 3p4. Để được cấu hình electron của nguyên tử khí hiếm gần nhất trong bảng tuần hoàn, nguyên tử lưu huỳnh nhận 2 electron. Lưu huỳnh thể hiện tính phi kim. Câu 10. Độ âm điện của một nguyên tử đặc trưng cho khả năng hút electron của nguyên tử nguyên tố đó khi hình thành liên kết hóa học. Trong nhóm A, khi đi từ trên xuống dưới theo chiều tăng của điện tích hạt nhân, giá trị độ âm điện của nguyên tử các nguyên tố nói chung là giảm dần. Câu 11. Nguyên tử của nguyên tố F có giá trị độ âm điện lớn nhất vì F có tính phi kim mạnh nhất. Người ta quy ước lấy độ âm điện của nó là 3,98 để xác định độ âm điện tương đối của các nguyên tố khác. Câu 12. Trong dãy chất sau: Li2O BeO B2O3 CO2 N2Og ch4 nh3 h20 hf hóa trị cao nhất đốì với oxi tăng dần từ 1 đến 5; hóa trị với hiđro giảm dần từ 4 đến 1.