Giải Hóa 10: Bài 8. Sự biến đổi tuần hoàn cấu hình electron nguyên tử của các nguyên tố hóa học
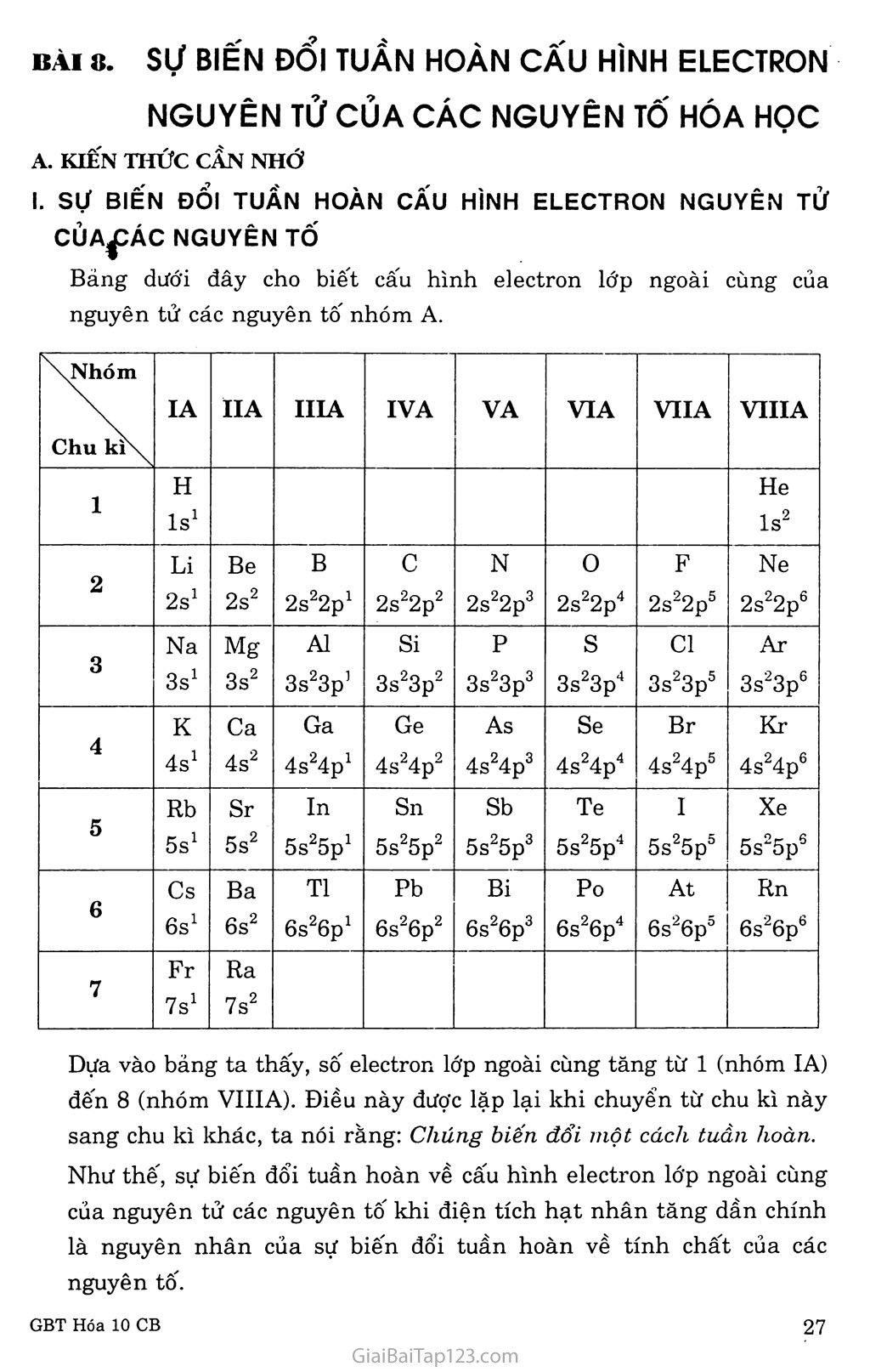
BÀI 8. Sự BIẾN ĐỔI TUẦN HOÀN CẤU HlNH ELECTRON NGUYÊN TỬ CỦA CÁC NGUYÊN Tố HÓA HỌC A. KIẾN THỨC CẦN NHỚ Sự BIẾN ĐỔI TUẦN HOÀN CÂU HÌNH ELECTRON NGUYÊN TỬ CỦA^DÁC NGUYÊN Tố Bảng dưới đây cho biết cấu hình electron lớp ngoài cùng của nguyên tử các nguyên tổ" nhóm A. \Nhóm Chu ki\ IA IIA IIIA IVA VA VIA VIIA VIIIA 1 H ls1 He ls2 2 Li 2s1 Be 2s2 B 2s22p1 c 2s22p2 N 2s22p3 0 2s22p4 F 2ss2p5 Ne 2s22p6 3 Na 3s1 Mg 3s2 AI 3s23p’ Si 3s23p2 p 3s23p3 s 3s23p4 Cl 3s23p5 Ar 3s23p6 4 K 4s1 Ca 4s2 Ga 4s24p2 Ge 4s24p2 As 4s24p3 Se 4s24p4 Br 4s24p5 Kr 4s24p6 5 Rb 5s1 Sr 5s2 In 5s25p1 Sn 5s25p2 Sb 5s25p3 Te 5s25p4 I 5s25p5 Xe 5s25p6 6 Cs 6s1 Ba 6s2 TI 6s26p1 Pb 6s26p2 Bi 6s26p3 Po 6s26p4 At 6s26p5 Rn 6s26p6 7 Fr 7s1 Ra 7s2 Dựa vào bảng ta thấy, số electron lớp ngoài cùng tăng từ 1 (nhóm IA) đến 8 (nhóm VIIIA). Điều này được lặp lại khi chuyển từ chu kì này sang chu kì khác, ta nói rằng: Chúng biến đổi một cách tuần hoàn. Như thế, sự biến đối tuần hoàn về cấu hình electron lớp ngoài cùng của nguyên tử các nguyên tố khi điện tích hạt nhân tăng dần chính là nguyên nhân của sự biến đổi tuần hoàn về tính chất của các nguyên tôi CẤU HÌNH ELECTRON NGUYÊN TỬ CỦA CÁC NGUYÊN Tố NHÓM A Cấu hình electron lớp ngoài cùng của nguyên tử các nguyên tố nhóm A Nguyên tử của các nguyên tố trong cùng một nhóm A có cùng số electron lớp ngoài cùng. Chính sự giống nhau về cấu hình electron lớp ngoài cùng của nguyên tử là nguyên nhân của sự giông nhau về tính chất hóa học của các nguyên tố trong cùng một nhóm A. số thứ tự của nhóm (IA, HA...) cho biết số electron ỏ' lớp ngoài cùng và đồng thời cũng là sô electron hóa trị trong nguyên tử của các nguyên tố đó. Các electron hóa trị của các nguyên tô thuộc hai nhóm A đầu là electron s, các nguyên tô' đó là các nguyên tố s. Các electron hóa trị của các nguyên tố thuộc 6 nhóm A tiếp theo là các electron s và p các nguyên tố đó là các nguyên tố p (trừ He). Một số nhóm A tiêu biểu Nhóm VIIIA là nhóm khí hiếm, gồm các nguyên tố: heli, neon, agon, kripton, xenon và rađon. Nguyên tử của các nguyên tố trong nhóm (trừ heli) đều có 8 electron ở lớp ngoài cùng (cấu hình electron lớp ngoài cùng là ns“np6). Đó là câu hình electron bền vững. Nhóm IA là nhóm kim loại kiềm, gồm các nguyên tố: liti, natri, kali, rubiđi, xesi (ngoài ra còn có nguyên tố phóng xạ franxi). Nguyên tử của các nguyên tố kim loại kiềm chỉ có 1 electron ở lớp ngoài cùng (cấu hình electron lớp ngoài cùng là ns1). Các kim loại kiềm là những kim loại điển hình, thường có những phản ứng sau: Tác dụng mạnh với oxi tạo thành oxit bazơ tan trong nước, thí dụ Li2O, Na2O,... Tác dụng mạnh với nước ỏ' nhiệt độ thường tạo thành hiđro và hiđroxit kiềm mạnh, thí dụ NaOH, KOH,... Tác dụng với các phi kim khác tạo thành muôi, thí dụ NaCl, K2S... Nhóm VIIA là nhóm halogen, gồm các nguyên tố: flo, clo, brom, iot (ngoài ra còn có nguyên tố phóng xạ atatin). Nguyên tử của các nguyên tố halogen có 7 electron ở lớp ngoài cùng (cấu hình electron lớp ngoài cùng là ns2np5). ở dạng đơn chất, các phân tử halogen gồm hai nguyên tử: F2, Cl2, Br2, I2. Đó là những phi kim điển hình, thường có những phản ứng sau: Tác dụng với kim loại cho các muối như: KBr, A1C13)... Tác dụng với hiđro tạo thành hợp chất khí HF, HC1, HBr, HI; trong dung dịch nước chúng là những axit. HiđrGxit của các halogen là những axit, thí dụ: HC1O, HCIO3. B. HƯỚNG DẨN GIẢI BÀI TẬP SGK TRANG 4l Câu 1. Chọn c Câu 2. Chọn c Câu 3. Những nguyên tố thuộc nhóm IA, IIA là các nguyên tố s. Những nguyên tố thuộc nhóm IIIA, IVA, VA, VIA, VIIA, VIIIA là các nguyên tố p. Số electron thuộc lớp ngoài cùng trong nguyên tử của các nguyên tố s là 1 và 2. Số electron thuộc lớp ngoài cùng trong nguyên tử của các nguyên tố p là 3, 4, 5, 6, 7, 8. Câu 4. Những nguyên tố kim loại kiềm đứng đầu các chu kì. Cấu hình electron của nguyên tử các nguyên tố kim loại kiềm có le lớp ngoài cùng. Câu 5. Những nguyên tố khí hiếm đứng cuối các chu kì. Cấu hình electron của nguyên tử các nguyên tố khí hiếm có 8e ở lớp ngoài cùng (riêng He là 2e). Câu 6. Nguyên tố ỏ' chu kì 3, nhóm VIA nên suy ra nguyên tử của nguyên tố này có 6e ở lớp ngoài cùng là lớp thứ ba. Cấu hình electron: ls2 2s2 2pc 3s2 3p4 Câu 7. Số electron hóa trị của từng nguyên tố: s ls2 2s2 2p4: có 6 electron hóa trị. ls2 2s2 2p3: có 5 electron hóa trị. ls2 2s2 2p6 3s2 3ph có 3 electron hóa trị. ls2 2s2 2p6 3s2 3p5: có 7 electron hóa trị. Ví trí (chu kì, nhóm) của các nguyên tố: Dựa vào cấu hình electron của nguyên tử cho biết: Số lớp electron suy ra số thứ tự của chu kì. Các electron lớp ngoài cùng là electron s và electron p nên chúng đều là nguyên tố p, do vậy chúng thuộc nhóm A, vì thế số electron ngoài cùng cho biết số thứ tự của nhóm. ls2 2s2 2p4: thuộc chu kì 2, nhóm VIA. ls2 2s2 2p3: thuộc chu kì 2, nhóm VA. ls2 2s2 2p6 3s2 3ph thuộc chu kì 3, nhóm IIIA. ls2 2s2 2p6 3s2 3p5: thuộc chu kì 3, nhóm VIIA.