SGK Hóa Học 9 - Bài 18: Nhôm
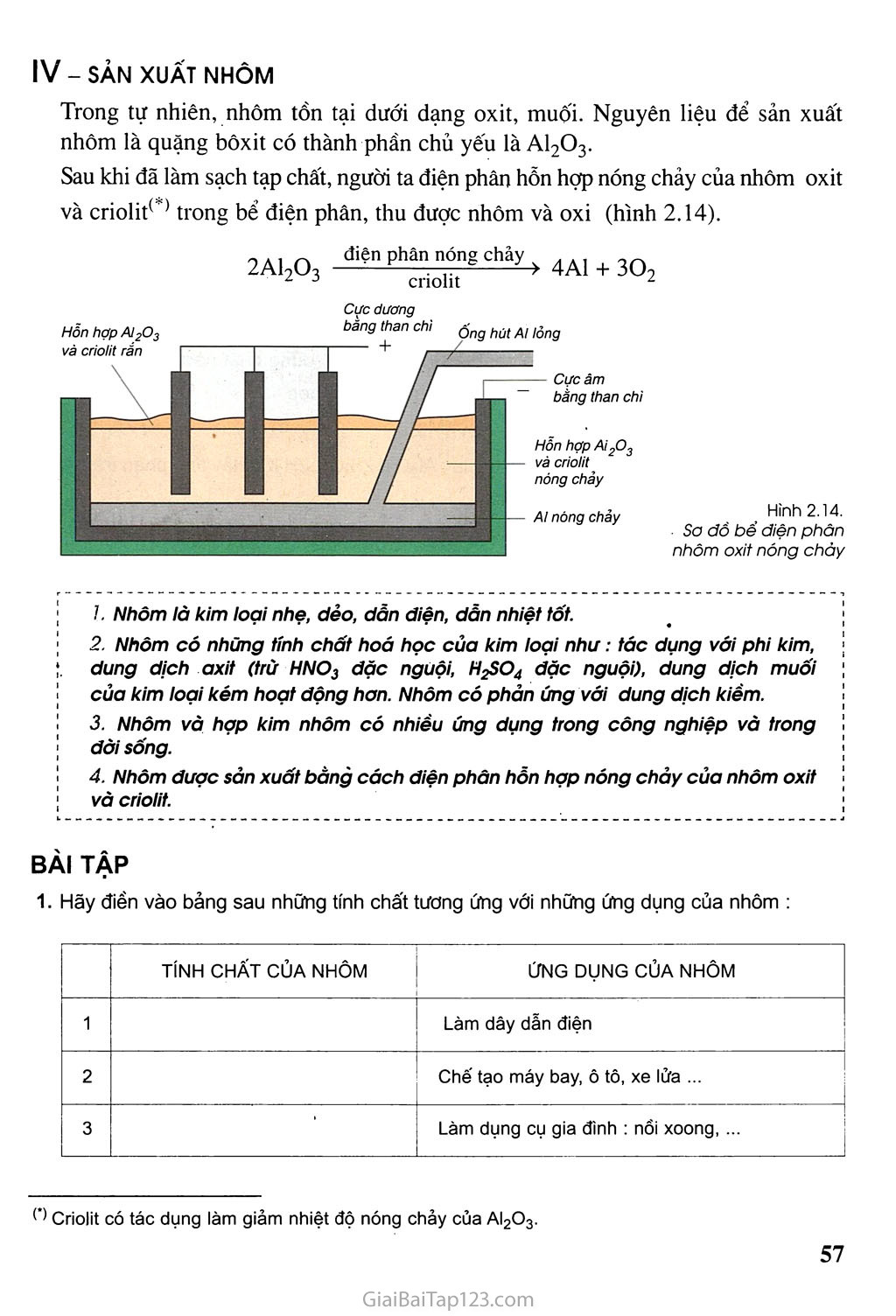
Bài 18 (1 tiết) Nhôm Nhôm là nguyên tố phổ biến thứ ba trong vỏ Trái Đất và có nhiều úng dụng trong đòi sống và sởn xuất. Nhôm có tính chất vật lí, hoá học. nào và có úng dụng gỉ quan trọng ? Kí hiệu hoá học : AI. Nguyên tủ khối: 27. I - TÍNH CHẤT VẬT LÍ Nhôm là kim loại màu trắng bạc, có ánh kim, nhẹ (khối lượng riêng là 2,7 g/cm3), dẫn điện, dẫn nhiệt tốt, nóng chảy ở 660 °C. Độ dẫn điện của nhôm bằng 2/3 độ dẫn điện của đồng. Nhôm có tính dẻo nên có thể cán mỏng hoặc kéo thành sợi. TÍNH CHẤT HOÁ HỌC Nhôm -có những tính chất hoá học của kim loại không ? Phản ứng của nhôm với phi kim Phản ứng của nhôm với oxỉ. ■ Thí nghiệm : Rắc bột nhôm trên ngọn lửa đèn cồn (hình 2.10). Hiện tượng : Nhôm cháy sáng tạo thành chất rắn màu trắng. Nhận xét: Nhôm cháy trong oxi tạo thành A12O3. 4A1 (r) + 3O2 (k) > 2AlọO3 (r) (trắng) (không màu) (trắng) Ở điều kiện thường, nhôm phản ứng với oxi tạo thành lớp A12O3 mỏng bền vững. Lớp oxit này bảo vệ đồ vật bằng nhôm, không cho nhôm tác dụng với Hình 2.10. ' \ 1. ' Đốt bột nhôm trong không khí oxi trong không khí và nước. Phản ứng của nhôm với phi kim khác Nhôm phản ứng được với nhiều phi kim khác như s, Cl2,... tạo thành muối Alọ^, A1Q3... Thí dụ : Ở nhiệt độ thường, nhôm tác dụng với khí clo tạo thành muối nhôm clorua : 2A1 (r) + 3Cl2-6t) 2A1C13 (;■) (trắng) (vàng lục) (trắng) Nhôm phản ứng với oxi tạo thành oxit và phản ứng với nhiều phi kim khác như s, Cl2 ... tạo thành muối. Phản ứng của nhôm với dung dịch axit Nhôm phản ứng với một số dung dịch axit như HC1, H2SO4 loãng ... giải phóng khí Họ. Thí dụ : 2A1 (r) + 6HC1 (dd) > 2AICI3 (dd) + 3Họ (k) (trắng) (không màu) (không màu) (không màu) Chú ý : Nhôm không tác dụng với HiSO4 đặc, nguội và HNO3 đặc, nguội. Phản ứng của nhôm với dung dịch muối Thí nghiệm : Nhôm phản ứng với dung dịch CuCh (hình 2.12). Cho một dây nhôm vào dung dịch CuClọ. Hiện tượng : Có chất rắn màu đỏ bám ngoài dây nhôm. Nhôm tan dần. Màu xanh lam của dung dịch CuCl2 nhạt dần. Nhận xét: Nhôm đẩy đồng ra khỏi dung dịch CuCl2. 2Al(r) + 3CuC12 (dd) > 2AICI3 (dd) + 3Cu(r) (trắng) (xanh lam) (không màu) (đỏ) • Nhôm còn có phản ứng tương tự với dung dịch AgNO3,... Nhôm phản ứng được với nhiều dung dịch muối của những kim loại hoạt dộng hoá học yếu hơn tạo ra muối nhôm và kim loại mới. Kết luận : Nhôm có những tính chất hoá học của kim loại. Nhôm có tính chất hoá học nào khác ? -*■ Thí nghiệm : Cho dây nhôm vào ống nghiệm đựng dung dịch NaOH (hình 2.13). Hiện tượng : Có khí không màu thoát ra, nhôm tan dần. Nhận xét: Nhôm có phản ứng với dung dịch kiềm. Ill-ỨNG DỤNG Nhôm và hợp kin/ ) nhôm được sử dụng rộng rãi trong đời sống như : đồ dùng gia đình, dây dẫn điện, vật liệu xây dưng ... Đuyra (hợp kim của nhôm với đồng và một số nguyên tố khác như mangan, sắt, silic) nhẹ và bền được dùng trong công nghiệp chế tạo máy bay, ô tô, tàu vũ trụ ... Hình 2.11. Nhôm phàn úng với dung dịch Hơ Hình 2.12. Nhôm phàn úng với dung dịch Cuơ2 Hình 2.13. Nhôm phởn ủng với dung dịch NaOH Xem bài 20 - SẢN XUẤT NHÔM Trong tự nhiên, nhôm tồn tại dưới dạng oxit, muối. Nguyên liệu để sản xuất nhôm là quặng bôxit có thành phần chủ yếu là A12O3. Sau khi đã làm sạch tạp chất, người ta điện phân hỗn hợp nóng chảy của nhôm oxit và criolitc ’ trong bể điện phân, thu được nhôm và oxi (hình 2.14). 2A12O3 điện phân nóng chảy . ... . — 4A1 + 3Oọ Hỗn hợp AI2O3 và criolit rắn Cực dương bằng than chi ộng hút Al lỏng Cực âm bằng than chi Hỗn hợp Ai2O3 và criolit nóng chảy AI nóng chảy criolit z Hình 2.14. So đồ bể điện phân nhôm oxit nóng chày ỉ. Nhôm là kim loại nhẹ, dẻo, dần diện, dẫn nhiệt tốt. Nhôm có những tính chất hoá học của kim loại như : tác dụng với phi kim, ;. dung dịch axit (trù HNOị dặc nguội, H2SO4 dặc nguội), dung dịch muối của kim loại kém hoạt dộng hơn. Nhôm có phản úng với dung dịch kiềm. Nhôm và hợp kim nhôm có nhiều ứng dụng trong công nghiệp và trong dời sống. Nhôm duợc sản xuất bằng cách diện phân hồn hợp nóng chảy của nhôm oxit và criolit. Ì. — — — — — — — — — — — — — — — — — — — — — — — — — — — — — — — — — — — — — — — — — — — — — — — — — — — — — — — — — — — — — — — — — — BÀI TẬP Hãy điền vào bảng sau những tính chất tương ứng với những ứng dụng của nhôm : Criolit có tác dụng làm giảm nhiệt độ nóng chảy của AI2O3. TÍNH CHẤT CỦA NHÔM ỨNG DỤNG CỦA NHÔM 1 Làm dây dẫn điện 2 Chế tạo máy bay, ô tô, xe lửa ... 3 • Làm dụng cụ gia đình : nổi xoong, ... Thả một mảnh nhôm vào các ống nghiệm chứa các dung dịch sau : a) MgSO4 ; b) CuCI2 ; c) AgNO3 ; d) HCI. Cho biết hiện tượng xảy ra. Giải thích và viết phương trình hoá học. Có nên dùng xô, chậu, nồi nhôm để đựng vôi, nước vôi tôi hoặc vữa xây dựng không ? Hãy giải thích. Có dung dịch muối AlClg lẫn tạp chất là CuCI2. Có thể dùng chất nào sau đây để làm sạch muối nhôm ? Giải thích và viết phương trình hoá học. a) AgNO3; b) HCI ; c) Mg ; d) AI ; e) Zn. Thành phần hoá học chính của đất sét là : AI2O3. 2SiO2. 2H2O. Hãy tính phần trăm khối lượng của nhôm trong hợp chất trên. 6*. Để xác định thành phần phần trăm khối lượng của hỗn hợp A gồm bột nhôm và bột magie, người ta thực hiện hai thí nghiệm sau : Thí nghiệm 1 : Cho m gam hỗn hợp A tác dụng hết với dung dịch H2SO4 loãng dư, thu được 1568 ml khí ở điều kiện tiêu chuẩn. Thí nghiệm 2 : Cho m gam hỗn hợp A tác dụng với dung dịch NaOH dư, sau phản ứng thấy còn lại 0,6 gam chất rắn. Tính phần trăm khối lượng của mỗi chất trong hỗn hợp A.