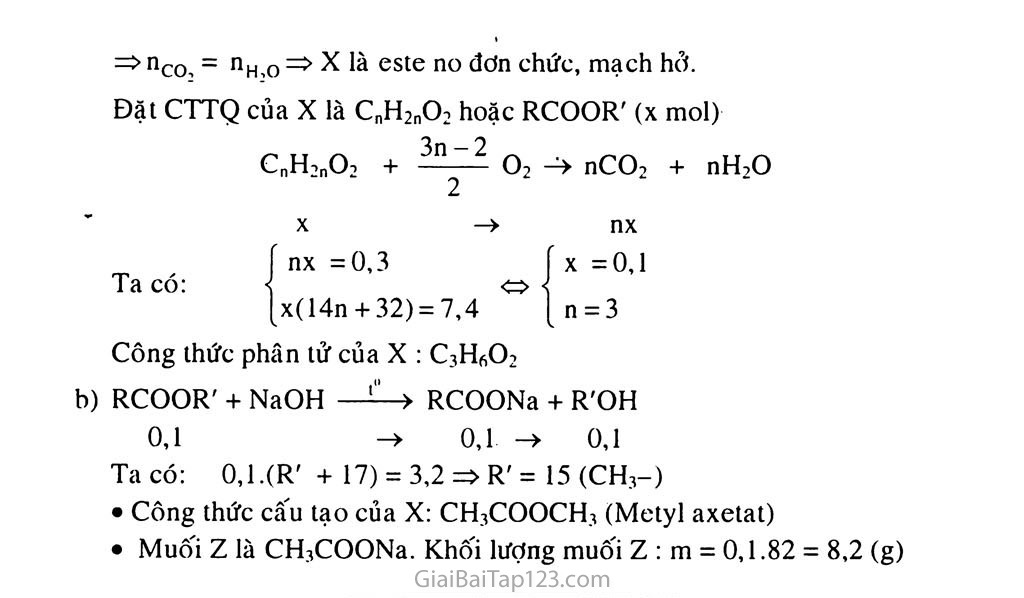Giải bài tập Hóa 12 Bài 1: Este
§1. ESTE TÓM TẮT Lí THUYẾT KHÁI NIỆM - ĐIỀU CHẾ VÀ ĐẶC ĐIEM cấu tạo Khái niệm Estc của axit cacboxylic là sản phẩm thay thế nhóm -OH ỗ nhóm cacboxyl của axit bằng nhóm -OR', với R' là gốc hiđrocacbon. Điều chế Phản ứng giữa axit và ancol rcoỊoh + hỊo-R' , H^đ’l0-> RCOOR' + H2O CH3COOH + HO-C2H5 ( H2s°4đ,t°,_>CH3COOC2H5 + H2O Phản ứng giữa anhiđrit axit và ancol R-C-O-C-R + HO-R' RCOOR' + RCOOH II II O O Đặc biệt: CH3COOH + CHsCH —CH3COOCH=CH2 Đặc điểm cấu tạo của este đơn chức R-C-OH > R-C-O-R' II. DANH PHÁP VÀ TÍNH CHAT VẬT LÍ 1. Danh pháp Như vậy khi viết công thức câu tạo của este phải hill ý vị trí của các nguyên tố o và c. Vị trí các nguyên tố này phụ thuộc vào gốc axit và ancol. Ten thông thường: |Tcn gốc hiđrocacbon của ancol + tên các axit đổi ic thành at Mctyl fomat Etyl axctat Mctyl acrylat Đietyl oxalat Ví dụ: HCOOCH.Í CH3COOC2H5 CH2=CH-COOCH3 COO-C2H5 COO-C2H5 Tính chát vật lí Estc của axit cacboxylic là những chất lỏn’g dỗ hay hơi. Estc có nhiệt độ sôi tháp hơn so vơi các axit cacboxylic và ancol có cùng sô' nguyên tử c (do không có liên kết hiđro giữa các phân tử cstc). Các cstc đều nhẹ hơn nước, ít tan trong nước, chúng đều có mùi thơm dễ chịu giông mùi thơm của quả chín. • CH3-COO-CH2-CH2-CH-CH3: Isoamyl axctat (mùi dầu chuối) CH3-CH2-CH-COO-C2H5 : Etyl butirat (mùi dứa) CH3-COO-CH2-C6H5 : Benzyl axctat (mùi hoa nhài) TÍNH CHẤT HÓA HỌC Phản ứng ở nhóm chức h,so4 .1" RCOOH + R'OH (ancol bền) a) Thủy phân trong môi trường axit vô cơ ♦ Tổng quát: RCQOR' + H)-OH < Ví dụ: CH3COOC2H5 + H-OH CH3COOH + C2H5OH b) Thủy phân trong môi trường kiềm (NaOH, KOH) ♦ Tổng quát: RCOOR' + NaOH ——» RCOONa + R'OH (ancol ben) Ví dụ: CH3COOC2H5 + NaOH ■- -> CHsCOONa + C2H5OH Phản ứng ỏ' gốc hiđrocachon Có thể tham gia phản ứng cộng và trùng hợp nếu gốc hiđrocacbon của axit hoặc ancol chưa no. CH3COOCH=CH2 + H2 NLi" > CH3COOCH2-CH3 CH3 CH3 I A V| n I nCH?=Ọ —1 ’ > (-CH2-C )rt-(Thủy tinh hữu cơ) COOCH3 COOCH3 KIẾN THỨC BỔ SUNG Công thức chung của một số dãy đồng đẳng của este Este no đơn chức mạch hở : Estc tạo từ axit no đơn chức và ancol no đơn chức C,1H2„+iCOOC„1H2„lTi hoặc Cn+,n+iH2n+2m+2C>2 hoặc CkHọkCE hoặc RCOO R' (vơi n > 0, m > 1. k > 2) Estc đơn chức mạch hở: Estc tạo từ axit đơn chức và ancol đơn chức CxHvCOOCx-Hv hoặc C„HmO2 hoặc RCOOR' Estc đa chức mạch hở (chỉ chứa một loại nhóm chức): Có hai dạng thường gặp: Este tạo từ axit đa chức R(COOH)„ và ancol đơn chức R'OH R(COOR')„ Estc tạo từ axit đơn chức RCOOH và ancol đa chức R'(OH)n (RCOO)n R' hoặc R'(OCOR)n(phổ biến) Thủy phân este hằng dung dịch kiềm (NaOH, KOH) Thông thường thu được muôi và ancol, tuy nhiên với những cste tạo từ ancol không no hoặc phenol có thể có các trường hựp đặc biệt sau đây: Este đơn chức + NaOH (KOH) — -—> Muối + anđehit RCOOCH=R' + NaOH ——> RCOONa + R"CHO <— - [R'=CH-OHj Ví du: CHiCOOCH-CPE + NaOH ——-> CH3COONa + CH3CHO Este đơn chức + NaOH (KOH) —- —> Muối + xeton RCOOC-R" + NaOH > RCOONa + R' c R'" <• 1 H [R"=C-R' R'. ò OH Ví du: HCOOC=CH, + NaOH 1 “ —> HCOONa + CH - £-ch3 CH, Ổ Este đơn chức + NaOH (KOH) —- —> Muối + muối + H2O RCOOC6H5 + NaOH RCOONa + CfiHsOH C6H5OH + NaOH > C6H5ONa + H2O. RCOOCfcH, + 2NaOH dư > RCOONa + C6H5ONa + H2O. => Este của phenol là este đơn chức duy nhất tác dụng với dung dịch NaOH hoặc KOH theo tí lệ mol nkiím: nr; = 2 : 1. Chứ ý : Anđehit và xeton tạo thành trong trường hợp này là do hỗ biến từ ancol không bền (ancol có chứa c vừa mang nối đôi c=c vừa mang.-OH hoặc ancol có một c mang hai nhóm -OH). Một số este đặc biệt « ♦ Este cháy cho nco = nH 0 là esle no đơn chức mạch hở C,,H2l,+iCOOCmH2m+i hoặc (CkH2kO2) ♦ Este tác dụng vơi dung dịch NaOH (KOH) vơi tỉ lệ mol nNaOH ■ = n hoặc nKOH : ni; = n (n * 1) là este đa chức (RCOO)„R' hoặc R(COOR')n hoặc R„(COO)„ ,mR'm. Thông thường trong chương trình phổ thông thường gặp este tạo bơi axit đa chức và ancol đơn chức R(COOR')n hoặc este tạo từ axit đơn chức và ancol đa chức (RCOO)„R'. Chú ý: mpẩn rctMuối + ^Kiềni du- Trong trương hợp kiềm thiếu, châ't rắn thu được sau phản ứng chỉ có muối. Một bài lập về este có hai giả thiết là đốt cháy và thủy phân, nên sử dụng giả thiết dốt cháy trươc để tìm CTPT, sau đó dùng giả thiết thủy phân để - Thủy phân este bằng dung dịch kiềm (NaOH; K.OH) dề hài cho số mol kiềm VÌ1 không báo vừa đủ thông thương kiềm dư tìm CTCT. Viết công thức câu tạo của este Dựa vào công thức tổng quát R-COO-R' Bước một: Thay R = H- ta được HCOOR', tiếp tục viết các dạng đồng phân về mạch c của R'. Bước hai: Thay R = CH?- ta được CH,COOR", tiếp tục viết các dạng đồng phân về mạch c của R". Bước ha: Thay R = C2H5- ta được CH3CH,COOR"', tiếp tục viết các dạng đồng phân về mạch c của R'". Tiếp tục như thế ta được các công thức câu tạo của cstc. MỌT SỐ VÍ DỤ MINH HỌA Ví dụ 1: Đốt cháy hoàn toàn 2,64 gam este X bằng một lượng oxi vừa đủ tint được 2,688 lít CO: (đktc) và 2,16 gam H:O. ỉ. Xác định công thức phân tử, công thức cấu tạo có thế có và gọi tên các este. Đun 3,52 gam X với 90 ml dung dịch NaOH IM. sau khi phản ứng kết thúc thu được dung dịch A. Cô cạn dung dịch A ở nhiệt độ thấp và áp suât kém thu được 5,28 gam chất rắn B. Xác định công thức cấu tạo đúng cua X. Trộn đều chất rắn B với CaO, sau đó nung nóng hỗn hợp, thu được V lít một khí Y ịđktc). Tính giá trị V. Giả thiết hiệu suất phản ứng là J00%. Giải _ , 2.16 _ , 1- nrn = — = 0,12mol; nH n „ = 0,12mol to; 22’4 - H,0 18 nco, - nH2O Đặt CTTQ của X là CnH2nO2 hoặc RCOO R' ( X mol) C„H2l,O2 + 02 -> nCO2 + nH2O nx = 0.12 x(14n + 32) = 2,64 Công thức phân tử của X : C4H«O2 Công thức câu tạo các cstc: HCOOCH2-CH2-CH? HCOOCH-CH? CH? CH?COOCH2-CH? CH3CH2COO-CH.3 3,52 Ta có: > nx X =0,03 n = 4 Propyl fomat Isopropyl fomat Etyl axetat Mctyl propionat 2. SỐ mol X: = 0,04 mol; số mol NaOH : 0,09.1 = 0,09 mol ■ X là cstc no đơn chức mạch hở RCOOR + NaOH - —RCOONa + R'OH Trước phản ứng 0,04 0,09 0 0 Phản ứng 0,04 -» 0,04 0,04 -> 0,04 Sau phản ứng 0 0,05 0,04 0,04 Dung dịch A : RCOONa 0,04 mol; R'OH 0,04 mol; NaỌH dư 0,05 mol. Cô cạn ancol R'OH bay hơi nên chát rắn thu được sau cùng gồm : RCOONa 0,04 mol; NaOH dư0,05 mol => 0,04.(R + 67) + 0,05.40 = 5,28 => R = 15 (CHj-) : Công thức ca'u tạo đúng của X là: CH3COOCH1CH3 CH.,COONa + NaOH Ca0-1" > CH4T + Na2CO3 Trước phản ứng 0,04 0,05 0 0 Phản ứng 0,04 -> 0,04 -> 0,04 -> 0,04 Khí Y là CH4. Thể tích khí Y ở đktc: V = 0,04.22,4 = 0,896 (lít). Ví dụ 2: Dốt cháy hoàn toàn m gam một este đơn chức mạch hà A cần vừa đúng 4,032 lít o? (đktc), thu dược 3,584 lít co? (đktc) vù 2,16 gam H?o. Mặt khác thủy phân hoàn toàn m gam X bằng một lượng KOH vừa đủ, chưng cất dung dịch sau phản ứng thu dược 1,28 gam ancol. Xác định công thức cấu tạo và gọi tên A. B là dồng phân của A. Đun m gam A với 50 ml dung dịch NaOH 1M, sau khi phản ứng kết thúc thu dược dung dịch X. Chưng cất dung dịch X (1 nhiệt độ thấp và áp suất thấp thu dược 3,68 gam chất rắn và a gam chất hữu cơ D. Xác định công thức cấu tạo và gọi tên B. Cho D tác dụng với một lượng dư Ag?o trong NH<. Tính khôi lượng kết tiía sinh ra. Giải Este đơn chức có chứa hai nguyên lử oxi trong phân tử. Đặt CTTQ của X là CXHVO2 hoặc RCOOR'(a mol) CXHXO2 + X t 1 02 —xCO2 + — H2O Ta có: y 4 y 4.032 a(x + --l) = ——- 4 22,4 a —» a I X + -— I 4 —> ax ay 7 ax = • 3,584 5 22,4 ay _ 2,16 2 18 a = 0,04 x=4 y = 6 CTPT của X: C4H6O2 RCOOR' + KOH -> RCOOK + R'OH 0,04 -> 0,04 Ta có : 0,04.(R' + 17) = 1,28 => R' = 15 (CH.,-) CTCT của X: CH2 = CH - coo - CH, (Mctyl acrylat) Theo bài D tham gia được phản ứng tráng gương nên D là anđehit => Công thức tổng quát của B là RCOOCH=R' RCOOCH = R' + NaOH -> RCOONa + R"CHO Trước phản ứng 0,04 0,05 0 0 . Phản ứng 0,04 —» 0,04 -> 0,04 -> 0,04 Sau phản ứng 0 0,01 0,04 0,04 Dung dịch X : RCOONa 0,04 mol; R"CHO 0,04 moi; NaOH Jlf 0,01 mol. Chưng cất anđchit R"CHO bay hdi nên chát rắn thu được sau cùng gồm : RCOONa 0,04 moi; NaOH dư0,01 mol => 0,04.(R + 67) + 0.01.40 = 3,68 => R = 15 (CH,-) Công thức cấu tạo của B: CHìCOOCH = CH2 (vinyl axetat) Theo bài B là CH,CHO < CH2 - CHOH (ancol không bền) CH,CHO + 2f Ag(NH,)2](OH) —> CH,COONH4 + 2Ag^+ 3NH, + H?o hoặcCH,CHO+2AgNO,+3NH(+H2O —í—> CH,COONH4+2Agị+2NH4NO, 0,04 -> 0,08 Khôi lượng kết tủa Ag sinh ra: mAg = 0,08.108 = 8.64 (g) Ví dụ 3: Chia 9,4 gam hồn hợp X gồm CHíCOOH và C:H?OH tliànlì hai phần bằng nhau. Clì<) phần một tác dụng với Na dư thu dược 1,008 lít H: (dklc). Tính khối lượng mồi chất trong hỗn hợp X. Đun phần hai với H2SO4 đặc thu được m gam este A vái hiệu suất 80%. Tính m. Hỗn hợp Y gồm 0.02 mol A vờ 0,04 moi một este B. Đốt cháy hoàn toàn hỗn hợp y cần vừa dáng 0,18 mol O2, thu dược 0,16 mol co 2 và 0,16 mol H:o. Xác định công thức cấu tao của B. Bằng phương pháp hóa học hãv trình bàv cách phân biệt A và B dựng trong hai lọ mất nhãn khác nhau. CH,COOH 2x mol 2y mol Giải 1. Đặt C2H,OH ♦ Phần 1: trong hỗn hợp X => 2x.6O + 2y.46 = 9,4 (*) CHìCOOH + Na —> CHíCOONa +-7 H21 (1) 2 x x —> — 2 (2) C2H5OH + Na -> C2H5ONa + -H2f 2 y -> 7 2 TỪ (1) và (2) => I + Ị (**) 2 2 22.4 x = 0,04 y = 0,05 Khôi lượng mỗi chát trong hỗn hợp X: Giải hệ (*) và (**) ta được CH,COOH = 2.0,04.60 = 4,8 (g); mC;HsOH= 2.0,05.46 = 4,6 (g) H,so.đ.t" 2. ♦ Phần 2: CH3COOH + HO-C2H5 <_■ J Trước phản ứng 0,04 0,05 H%=xo% Phản ứng 0,04 > CH3COOC2H5 + H2O 0 0 80 Khôi lượng cstc thu được: rriEsie = 0,032.88 = 2,816 (g) c) Áp dụng định luật bảo toàn khôi lượng ta có : 0,04.77-= 0,032 100 mA+mB+mo =mco + mH 0 0.02.88 + 0.04.Mb + 0,18.32 = 0.16.44 + 0.16.18 => Mb = 60 (C2H4O2) Công thức phân tử của B: C2H4O2 Công thức cấu tạo của B: HCOOCH3 (Mctyl fomat) Nhận biết CH3COOC2H.S và HCOOCH3 đựng trong hai lọ mất nhãn khác nhau. Thủy phân A và B trong môi trường axit vô cơ loãng. Chưng cất, cho sản phẩm tráng gương, sản phẩm tham gia được phản ứng tráng gương là sản phẩm của B. (HCOOH là axil hữu cơ duy nhất tham gia được phản ứng tráng gương vì trong cấu tạo phân tử của 1Ú) có nhóm -CHO) CH.íCOOC2H5 + H-OH CH3COOH + C2H5OH HCOOCH3 + H-OH HCOOH + CH3OH HCOOH + 2[Ag(NH3)2](.OH) —í—í> (NHO2CO3+ 2Agị+3NH3 + H2O Hoặc HCOOH+2AgNO3+4NH3+H2O—> (NH4)2CO3 +2Agị+2NH.,NO3 c. BÀI TẬP SÁCH GIÁO KHOA Hãy (til'll chit t> (tiling) lìnãc s (sai) vào ó trông tiên cạnh các câu suu : Este là sủn plìiỉni cùa phàn ứng giữa axit hữu cơ và ancol. Este là hợp chối hữu cơ trong phân tử có nlióni -COO . Este no, itơn cltức, mạch hi) có công thức phân tử C„Hỉ,(Oi, với n >2. ít) Hợp chốt CH.iCOOCìHi thuộc loại este. e) Sán phẩm cùa phân ứng giữa axit và ancol là este. ứng Vlii công thức phân từ CjHxOi có bao nhiêu e.ite đồng phán cua nhau ? .4. 2 li. 3 C.4 í). 5 t hát X có công thức phân tử CjHsO:, Khi X tác dụng vơi dung dịch NuOH sinh ra chát Y có câng thức CỉHsOỉNu. Còng thức cấu tạo của X là /I. HCỠOC.iH? lỉ.CiHsCOOCH., c. CHịCOOCiHị D. HCOOC.Hị Thiíy phân este X có công thức phân tử CjHsơ2 trong dung dịch NaOH thu được hỗn hợp 2 chất hữu cơ Ỵ và z, trong đó z có tỉ khối hơi so vời H2 hàng 23. Tên cùa X là A. etyl a.xetaỉ II. nietyl axetat c. tnetyl propionat D. propyl fomat Phán ứng thủy phân của este trong môi trường axit và môi trường haz<) khác nhau iì điểm nào ? Dốt cháy hoàn toàn 7,4 gam este X dim cluỉc thu dược 6,72 lít khí co2 tdktc) vù 5.4 gain nước, a) Xác dịnh công thức phân từ cùa X. h) Dun 7,4 gam X trong dung dịch NaOH vừa dii đến khi phàn ứng hoàn toàn thu dược 3,2 gam ancol X và một lượng muối z. Viết công thức cấu tạo cùa X vù tính khối lượng cùa z. Hướng dẫn giải HọSCỊị đ,l” ± CH3COOC2H5 + H2O 1. a) Đúng Ví dụ : CH3COOH + HO-C2H5 < Sai. Nhóm coo ứng vời axit hoặc muối. Ví dụ: CH3COOH, HCOONa... Đúng. V/Y/ụ; C2H4O2 (HCOOCH3) Đúng. Ví dụ: CH3COOC2H5 (etyl axctat) c) Sai. Ví dụ: CH3CH2OH + HBr NaBrtH;s°4 ) CH3CH2Br + H2O Chọn c. C4LLO2 có 4 đồng phân cstc Propyl fomat Isopropyl fomat Etyl axetat Motyl propionat -> CHiCOONa + C2H5OH H-COO-CH2-CH2-CH3 H-COO-CH-CH3 CH3 CH3-COO-CH2-CH3 CH3-CH2-COO-CH3 Chọn c. CH3COOC2H5 + NaOH — Chọn A dz/H = 23 => Mz = 46 (C2H5OH). z là C2H5OH, Y là CHsCOONa CH3COOC2H5+ NaOH -> CHsCOONa + C2H5OH 5. Sự khác nhau giữa phản ứng thủy phân cstc trong dung dịch axit và dung dịch kiềm: Trong dung dịch kiềm - Là phản ứng 1 chiều còn được gọi là phản ứng xà phòng hóa. Trong dung dịch axit Là phản ứng thuận nghịch H,so. ,1° . RC(X)R'+H-OH: Chậm RCOOH+ROH RCOOR'+NaOH -> RCOONa + R'OH - Nhanh 6. a) nco = = 0,3 mol; nH n= = 0,3 mol • 22,4 H2° 18 => nco, = nH o => X là este no đơn chức, mạch hở. Đặt CTTQ của X là CnH2nO2 hoặc RCOOR' (x mol) C„H2„O2 + ^7- 02 nCO2 + nH2O 2 X =0,1 n = 3 X -> nx Ta có: nx =0,3 x(14n + 32) = 7,4 Công thức phân tử của X : C2H6O2 RCOOR' + NaOH —RCOONa + R'OH 0,1 -> 0,1 -» 0,1 Ta có: 0,1.(R' + 17) = 3,2 => R'= 15 (CH.,-) Công thức cấu tạo của X: CH3COOCH3 (Metyl axetat) Muoi z là CH,COONa. Khối lượng muối z : m = 0,1.82 = 8,2 (g)