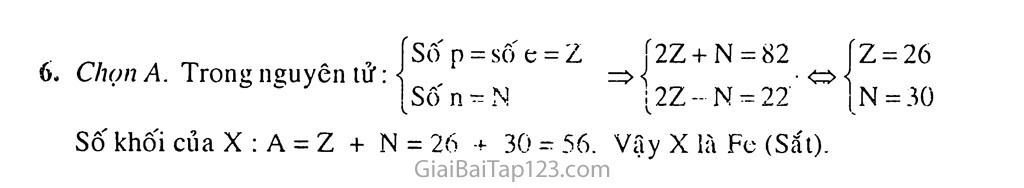Giải bài tập Hóa 12 Bài 37: Luyện tập: Tính chất hoa học của sắt và hợp chất của sắt
§37. LUYỆN TẬP : TÍNH CHAT HOÁ HỌC CỦA SẮT VÀ HỢP CHẤT SẮT • i BÀI TẬP SÁCH GIÁO KHOA 7. Hiền công thức hoá học cửa chất vào những chỗ trống và lâp các phương trình hoá học sau : ,0 at Fc+ H2SO4 đặt-——>so2 t +... 1° hi K- - HNO, it;U —-»NO, T+... I) I-V * HNO, loãng > NO T i... dl FeS + .HNO3 »NOT +Fe2(SO4)3 +... nằng phương pháp Itoá học, hãy phân biệt 3 mẫu hợp kim sau : Al—Fe. Al-Ctt rù Cu-Fe. Một liẵn hợp hột gồm AI. Fe, Cu. Hãy trình hãy phương pháp lioá học dề' tách riêng từng kim loại từ hồn hợp dó. Viết phương trình hoú học của các phùn ứng. Cho một ít hột sắt Iiguvên chát tác dụng hét với dưng drill H;SOj loãng thu dược 560 ml một chất khi rỉ dktc. Nếu cho mót lượng gấp dõi lìộl \ắl nói trên tác dụng liió Vlii dung dịch CuSOj tlú lliu dược một chất rắn. Tinh kliõi lương hột sắt dà dùng trong 2 trường ItỢp trùn vá kltối lượng cliất rắn thu dược. Cho 2.3 gain hỗn hợp gồm MgO. Cu() vù FeO tác dụng vdi một lượng vừa dù là 100 till dung dịch H;SOj 0.2M. Khối lượng muối thu dược là A. 3,6 gam. II. 3,7 gam. c. 3,8 gam. I). 3,9 gam. Nguyên tit cùa nguyên tò X có tổng số hạt proton, nơtron vừ electron là 82, trong dó sô hạt mang diện nhiều hơn sô hạt không mang diện là 22. Nguyên tô X là .4. sắt . II. hrtim. c. photplio. I), crom. Hướng dẫn giải Điền vào chỗ trống và lập phương trình : 2Fe + 6H2SO4 đặc nóng —» Fe2(SO4)3 + 3SO2t + 6H2O Fe + 6HNO3 đặc nóng —> Fe(NO3)3 + 3NO2T + 3H2O Fe + 4HNO3 loãng —» Fe(NO3)3 + NO? + 2H2O •d) 3FeS + 12HN0j -> Fe2(SO4)3 + Fe(NO3)3 + 9NOt + 6H2O ♦ Cho các mẫu thử lần lượt tác dụng với dung dịch HC1 dư. Mẩu tan hoàn toàn là Al-Fe: 2A1 + 6HC1 -> 2AICI3 + 3H2T Fe + 2HC1 -> FcCL + H2Í Hai mẫu còn lại chi tan một phần Mẩu Al-Cu : 2A1 + 6HC1 -> 2AICI3 + 3H2T. Lọc thu dung dịch. Mẩu Cu- Fe: Fe + 2HC1 —» FeCL + H2T. Lọc thu dung dịch . Cho dung dịch NaOH từ từ cho đến dư vào hai dung dịch vừa thu được. Mẩu tạo kết tủa dạng keo, kết tủa lan dần là mẫu Al-Cu. Mẩu còn lại là mẫu Cu-Fe. AICI3 + 3NaOH -+ Al(OH)3ị + 3NaCl A1(OH)3 + NaOHdư—> NaA102 + 2H2O. • Cho hỗn hợp tác dụng với dung dịch NaOH dư, lọc thu dung dịch X (NaA102 và NaOH dư); chất rắn Y (Fe và Cu). 2A1 + 2NaOH + 2H2O -> 2NaA102 + 3H2t Sục co2 dư vào dung dịch X, lọc thu kết tủa, nhiệt phân kết tủa và điện phân nóng chảy oxit tạo thành trong criolit thu được AI NaA102 + CO2dư + H2O -+ Al(OH)3ị + NaHCOj 2A1(OH)3 —A12O3 + 3H2O 2ALO3 J'1nc-Ni|.AiF„ > 4A1 + 302t • • Cho hỗn hợp Y tác dụng với dung dịch HC1 dư, lọc thu Cu và dung dịch z. Điện phân dung dịch z thu được Fe. FeCL JpdJ > Fe + Cl2t Fe + H2SO4 loãng -> FeSO4 + H2t 0,025 <- 0,025 = 22,4 Fe + CuSO4 —> FpSO4 + Cuị 2.0,025 . -> 0,05 Khôi lượng sắt đã dùng: m = 0,025.56 = 1,4 (g) Khôi lượng chát rắn: mCu = 0,05.64 = 3,2 (g) Cliọn D. Áp dụng định luật bảo toàn bảo toàn khối lượng ta có : ưt hòn hợp DXÌI L = mmi|(íi + nÌỊ_| 0 (vơi n^i — n^o) => 2,3 + 0,2.0,1.98 =mmu,íi +0,2.0,1.18 => mmuô-, = 3,9 (g) SỐ p = sô" e = 2 Í2Z + N = 82 fz = 26 => 5 • o Sô" n - N I2Z- -N = 22’ ỈN = 30 Chọn A. Trong nguyên tử: Số khối của X : A = z + N = 26 + 30