Giải Hóa 11 - Bài 31: Benzen và đồng đẳng: Một số hiđrocacbon thơm khác
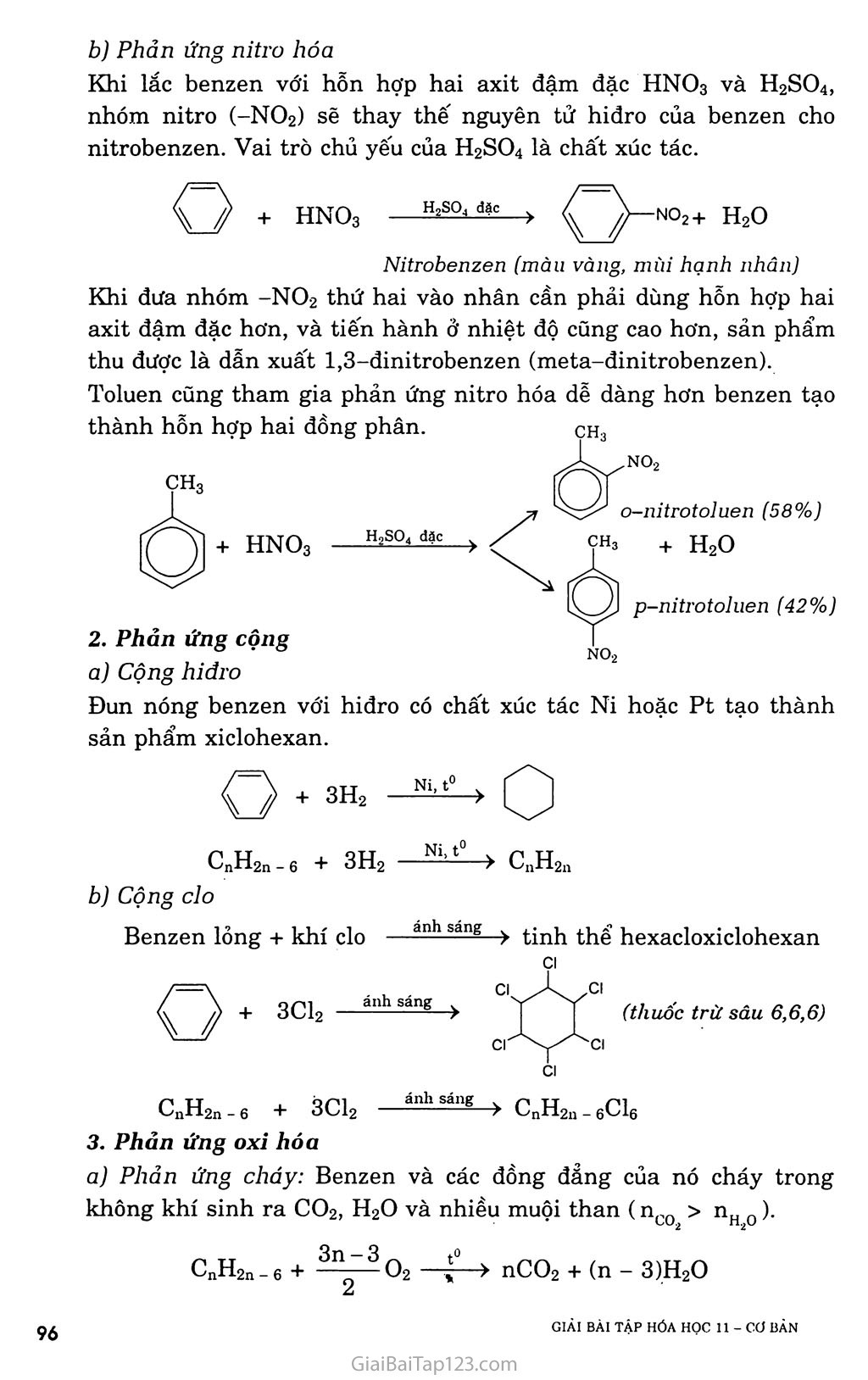
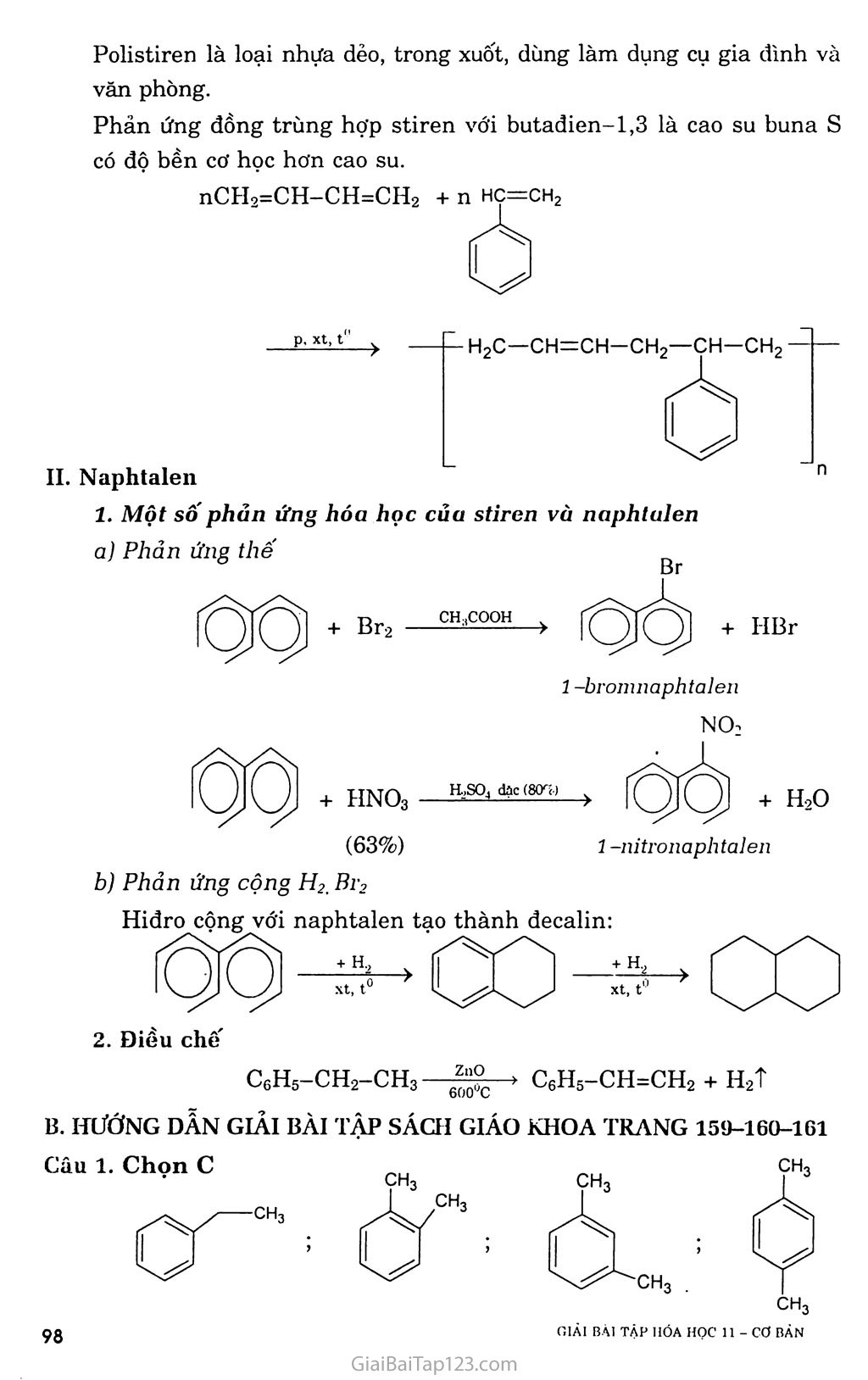
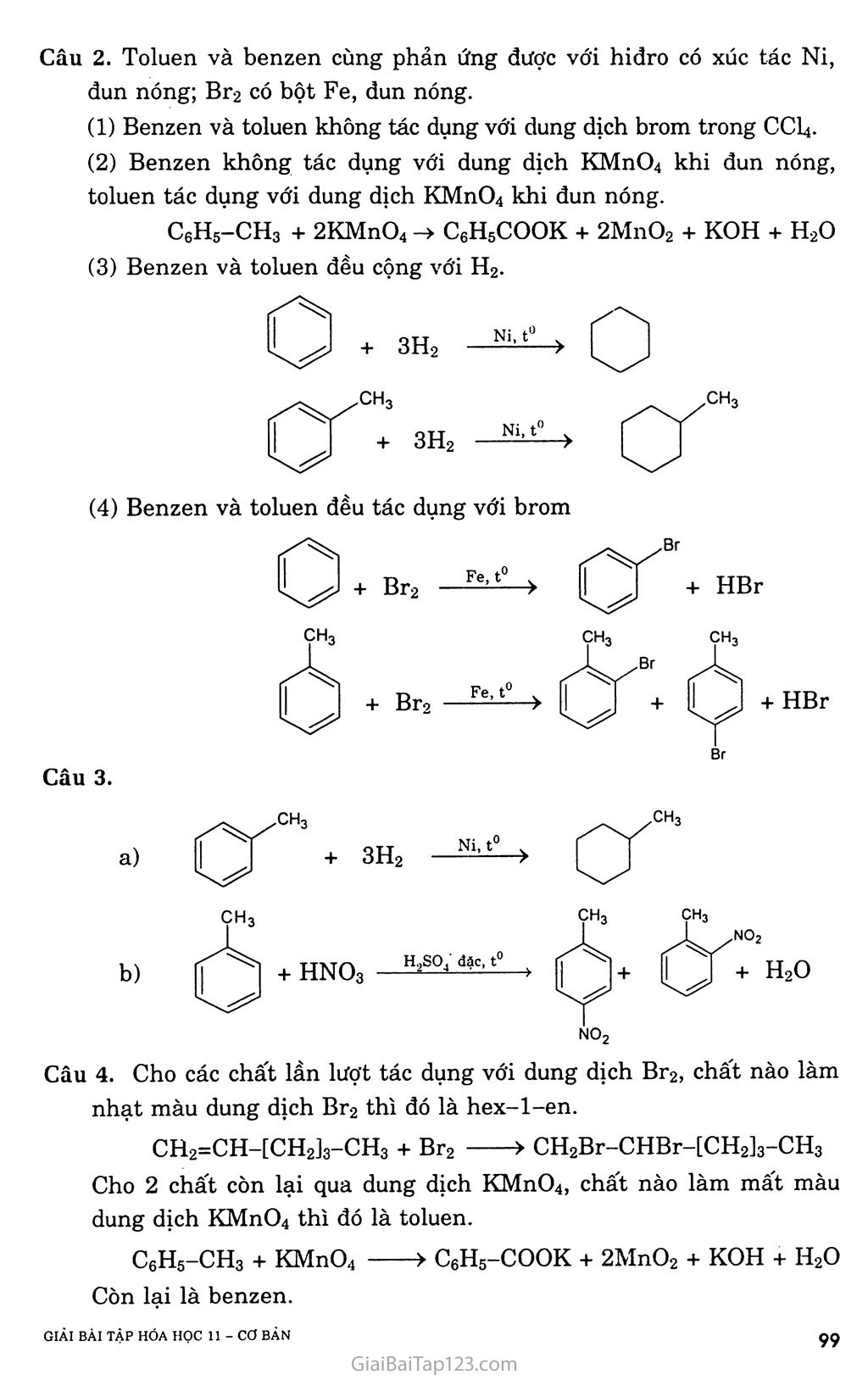
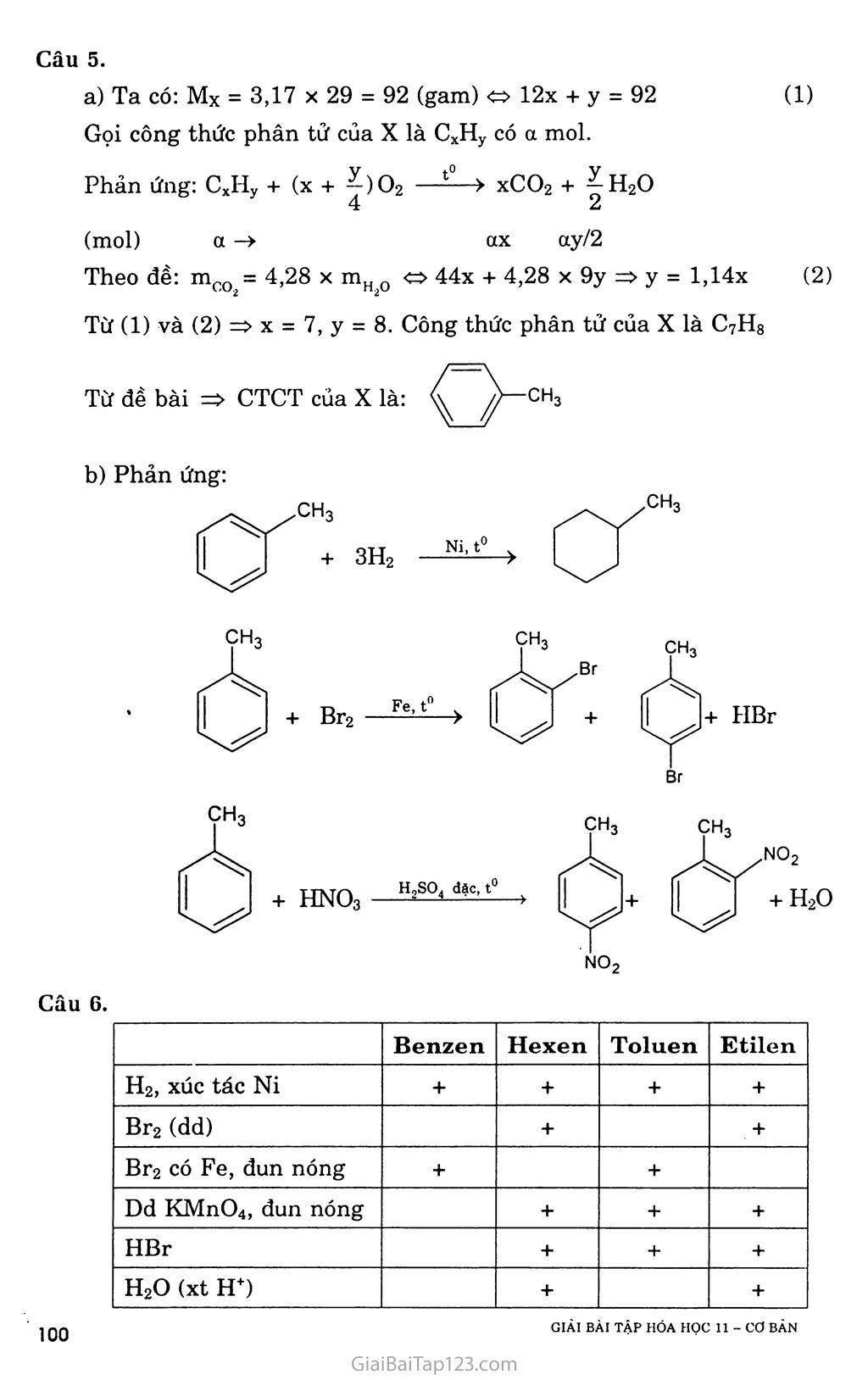
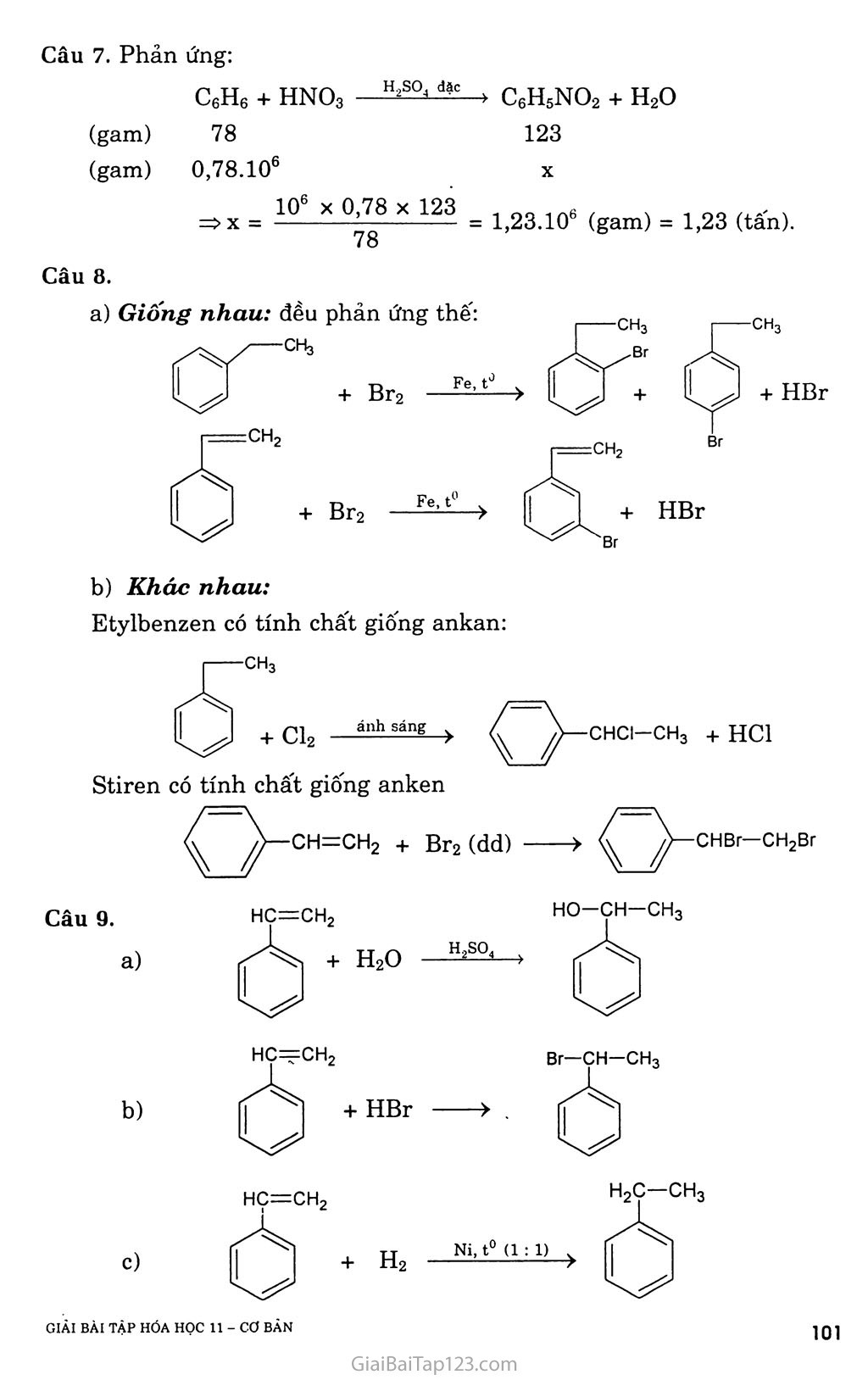
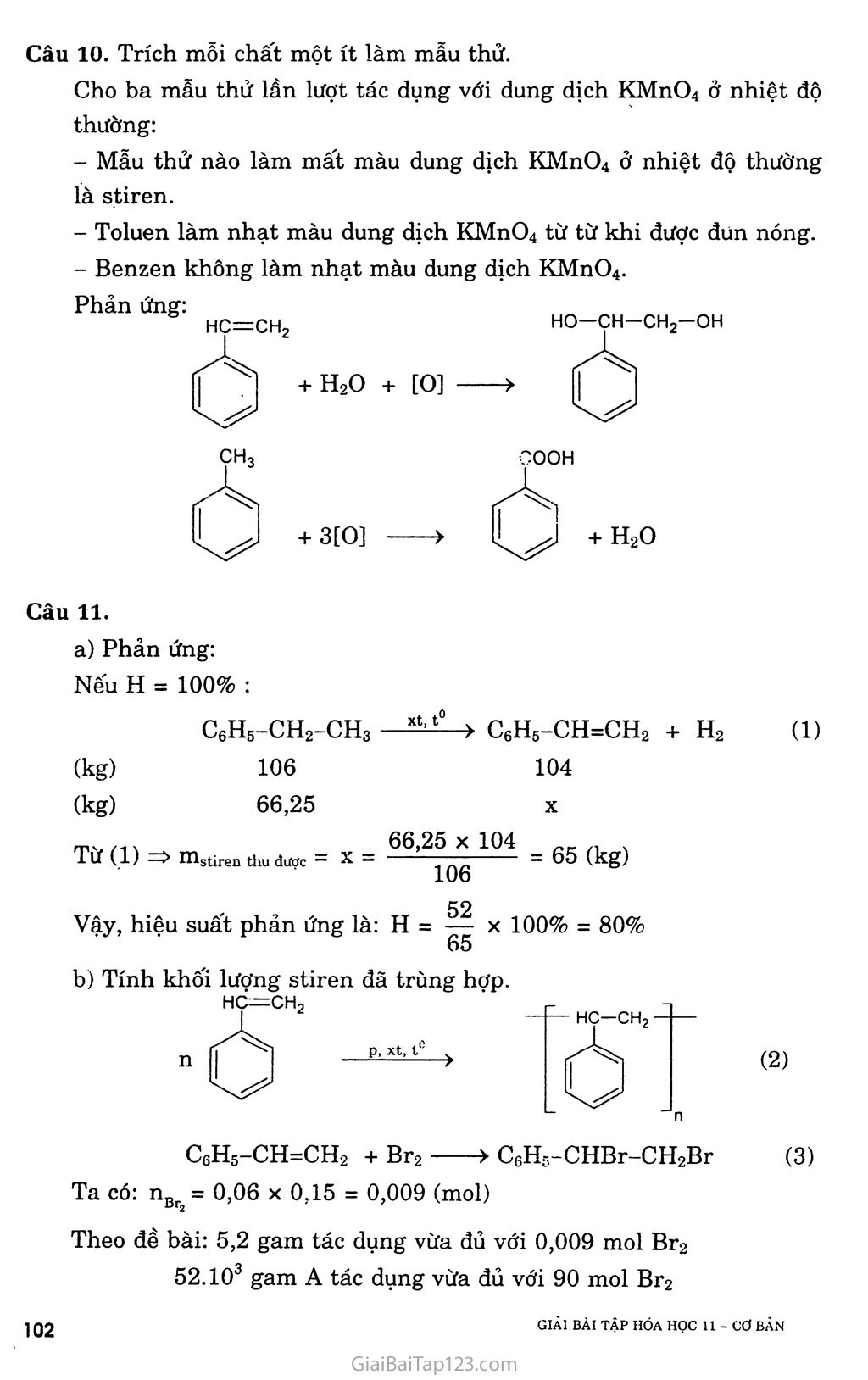
CHƯƠNG 7. HIĐROCACBON THƠM. NGUON HIĐROCACBON THIÊN NHIÊN. HỆ THỐNG HÓA VỀ HIĐROCACBON BÀI 31. BENZEN VÀ ĐỒNG ĐANG. MỘT SỐ H1ĐROCACBON THƠM KHÁC A. KIẾN THỨC CẦN NHỚ §1. BENZEN VÀ ĐỒNG ĐANG I. Tính chất hóa học Do cấu tạo đặc biệt như trên, nên benzen có những tính chất hóa học đặc trưng và gọi là tính thơm: dễ tham gia phản, ứng thế, khó tham gia phản ứng cộng và bền với tác nhân oxi hóa. Các đồng đẳng của benzen cũng có tính thơm, ngoài ra còn có các phản ứng của gốc ankyl. í. Phản ứng thê' a) Tác dụng với brom - Benzen không phản ứng với nước brom, nhưng dễ dàng phản ứng với brom khan khi có bột sắt làm xúc tác. Fe, t° + HBr - Toluen tham gia phản ứng brom ở vòng dễ dàng hơn và tạo thành hỗn hợp hai đồng phân. ch3 + Br2 — ch3 + HBr o-bromtoluen p-bromtoluen - Do ảnh hưởng của nhân thơm đối với mạch nhánh, nên khi chiếu sáng, toluen tham gia phản ứng thế nguyên tử hiđro ở nhóm CH3 dễ dàng hơn CH4. CH3 + Br2 --ánhsă^- CH2Br + HBr Benzyl brom na b) Phản ứng nitro hóa Khi lắc benzen với hỗn hợp hai axit đậm đặc HNO3 và H2SO4, nhóm nitro (~NO2) sẽ thay thế nguyên tử hiđro của benzen cho nitrobenzen. Vai trò chủ yếu của H2SO4 là chất xúc tác. H2SQ4 đặc no2+ h20 Nitrobenzen (màu vàng, mùi hạnh nhân) Khi đưa nhóm -NO2 thứ hai vào nhân cần phải dùng hỗn hợp hai axit đậm đặc hơn, và tiến hành ở nhiệt độ cũng cao hơn, sản phẩm thu được là dẫn xuất 1,3-dinitrobenzen (meta-đinitrobenzen). Toluen cũng tham gia phản ứng nitro hóa dễ dàng hơn benzen tạo thành hỗn hợp hai đồng phân. CH3 o-nitrotoluen (58%) + H2O no2 ỢH3 no2 CH3 + HNO3 —Has°4 đặc Phản ứng cộng a) Cộng hỉđro Đun nóng benzen với hiđro có chất xúc tác Ni hoặc Pt tạo thành sản phẩm xiclohexan. Ni, t° . -2 7 CnH2n_6 + 3H2 ■ N?--t0 ■■> CnH2n b) Cộng clo Benzen lỏng + khí clo —ănh săng > tinh thế hexacloxiclohexan CI CI Cl CI ánh sáng c Cl (thuốc trừ sâu 6,6,6) ■> CnH2u_6C16 c TJ _ ■ QO1 ánh sáng *-'nrl2n _ 6 + ơv;ì2 Phản ứng oxi hóa a) Phản ứng cháy: Benzen và các đồng đẳng của nó cháy trong không khí sinh ra co2, H2O và nhiều muội than (nco > nH 0). CnH2n_6 + ^02 nCO2 + (n - 3)H2O b) Tác dụng với dung dịch KMnO4 - Benzen không tác dụng với dung dịch KMnO4, nhưng toluen lại bị oxi hóa ở gốc -CH3 khi đun nóng với dung dịch KMnO4 tạo thành sản phẩm axit benzoic (C6H5COOH). C6H5-CH3 + 3[O] > CfiH5COOH + H2O hay C6H5-CH3 + 2KMnO4 -> C6H5COOK + 2MnO2 + KOH + HọO - Ngoài toluen, các đồng đẳng khác của benzen cũng bị oxi hóa thành các axit hữu cơ. II. Điều chế benzen và các chát đồng đẳng của henzen Phương pháp đề hìđro hóa a) Đề hiđro hóa xiclohexan Pd hoặc Pt 300°C > + 3H2T b) Đề hiđro hóa n-hexan đồng thời khép vòng CH3-(CH2)4-CH3 2°:tóo°3c > C*H* + 4H* Phương pháp tổng hợp a) Tổng họp Vuyec -Fittic Ví dụ: C6H5Br + 2Na + Br-CH3 -> C6H5 - CH3 + 2NaBr b) Tổng họp Friden - crap Ví dụ: C6H6 + C1-C2H5 A1C*3 > C6H5-C2H5 + HC1 §2. MỘT SỐ HIĐROCACBON THƠM KHÁC ch=ch2 I. Stiren Trong công thức cấu tạo của stiren có chứa đồng thời vòng benzen và gốc không no, nên nó có tính chất của hiđrocacbon thơm và tính chất của hiđrocacbon không no. Phản ứng trùng hợp stiren cho ra polistiren Polistiren là loại nhựa dẻo, trong xuốt, dùng làm dụng cụ gia đình và văn phòng. hc=ch2 Phản ứng đồng trùng hợp stiren với butađien-1,3 là cao su buna s có độ bền cơ học hơn cao su. nCH2=CH-CH=CH2 + II. Naphtalen 1. Một sô phản ứng hóa học của stiren vù naphtulen a) Phản ứng thê' 1 -bromnaphtalen no2 + hno3 (63%) trso, dạc (80%) > + ỉựo í -nitronaphtalen b) Phản ứng cộng H2, ĩh'2 Hiđro cộng với naphtalen tạo thành decalin: xt, t' + H2 xt, t° Điều chế c6h5-ch2-ch3—c6h5-ch=ch2 + h2t B. HƯỚNG DẪN GIẢI BÀI TẬP SÁCH GIÁO KHOA TRANG 159-160-161 Câu 1. Chọn c ch3 Câu 2. Toluen và benzen cùng phản ứng được với hiđro có xúc tác Ni, đun nóng; Br2 có bột Fe, đun nóng. Benzen và toluen không tác dụng với dung dịch brom trong CCI4. Benzen không tác dụng với dung dịch KMnO4 khi đun nóng, toluen tác dụng với dung dịch KMnO4 khi đun nóng. C6H5-CH3 + 2KMnO4 -> C6H5COOK + 2MnO2 + KOH + H2O Benzen và toluen đều cộng với H2. (4) Benzen và toluen đều tác dụng với brom no2 Câu 4. Cho các chất lần lượt tác dụng với dung dịch Br2, chất nào làm nhạt màu dung dịch Br2 thì đó là hex-l-en. CH2=CH-[CH2]3-CH3 + Br2 > CH2Br-CHBr-[CH2]3-CH3 Cho 2 chất còn lại qua dung dịch KMnO4, chất nào làm mất màu dung dịch KMnO4 thì đó là toluen. C6H5-CH3 + KMnO4 > C6H5-COOK + 2MnO2 + KOH + H2O Còn lại là benzen. GIẢI BÀI TẬP HÓA HỌC II - cơ BÀN ọọ Câu 5. Ta có: Mx = 3,17 X 29 = 92 (gam) » 12x + y = 92 (1) Gọi công thức phân tử của X là CxHy có a mol. Phản ứng: CxHy + (x + ^)O2 —“—> xCO2 + 7^H2O (mol) a -> ax ay/2 Theo đề: mco = 4,28 X mH 0 44x + 4,28 X 9y => y = l,14x (2) Từ (1) và (2) => X = 7, y = 8. Công thức phân tử của X là C7H8 Phản ứng: Br NO2 Câu 6. Benzen Hexen Toluen Etilen H2, xúc tác Ni + + + + Br2 (dd) + + Br2 có Fe, đun nóng + + Dd KMnO4, đun nóng + + + HBr + + + H20 (xt H+) + + Câu 7. Phản ứng: C6H6 + HNO3 H2S0 C6H5NO2 + H20 (gam) 78 123 (gam) 0,78.106 X _ _ 106 X 0,78 X 123 _ d Q0 1A6 , , _ . ,.A, , =>x = —F7O = 1,23.10 (gam) = 1,23 (tan). 78 Câu 8. a) Giống nhau: đều phản ứng thế: Khác nhau: Etylbenzen có tính chất giống ankan: CHCI—ch3 Stiren có tính chất giống anken + HC1 Câu 10. Trích mỗi chất một ít làm mẫu thử. Cho ba mẫu thử lần lượt tác dụng với dung dịch KMnO4 ở nhiệt độ thường: - Mẫu thử nào làm mất màu dung dịch KMnO4 ở nhiệt độ thường là stiren. Toluen làm nhạt màu dung dịch KMnO4 từ từ khi được đun nóng. Benzen không làm nhạt màu dung dịch KMnO4. Câu 11. a) Phản ứng: Nếu H = 100% : (1) C6H5-CH2-CH3 xt|t° > C6H5-CH=CH2 + H2 52 Vậy, hiệu suất phản ứng là: H = -“ X 100% = 80% 65 b) Tính khối lượng stiren đã trùng hợp. CeH5-CH=CH2 + Br2 > C6H5-CHBr-CH2Br (3) Ta có: nBr = 0,06 X 0,15 = 0,009 (mol) Theo đề bài: 5,2 gam tác dụng vừa đủ với 0,009 mol Br2 52.103 gam A tác dụng vừa đủ với 90 mol Br2 Từ (3) => nstiren = nBr^ = 90 (moi) => mstiren = 90 X 104 = 9360 (gam) = 9,36 (kg) Khôi lượng stiren đã tham gia trùng hợp là: ai stiren đã trùng hợp “ m,\ ~ n^stiren = 52 — 9,36 = 42,64 (kg). Hệ số trùng hợp là: n = = 3000 104 Câu 12. Úp miệng phễu có gắn giấy đục lỗ trên hỗn hợp naphtalen và tạp chất, đun nóng (thí nghiệm hình 7.3 SGK Hóa 10 cơ bản trang 157), naphtalen thăng hoa tạo các tinh thể hình kim bám trên mặt giấy, ta thu được naphtalen tinh khiết. Câu 13. Viết phản ứng thực hiện dãy biến hóa: C6H6 + CH2=CH2 —‘ỉ—> C6H5-C2H5 (1) C6H5-CH2-CH3 —> C6H5-CH=CH2 + H2 (2) 1 X 106 Ta có: n = —— (mol) L:6riG Ỹ8 Từ (1) và (2) => nstiren = nbenzen, vì hiệu suất là 78% nên: _ „ _ „ _ 106 78 _ in4, n n stiren = nccH6 = X = 10 (mol) Vậy: m stiren = 104 X 104 = 1040000 (gam) = 1,04 (tấn).