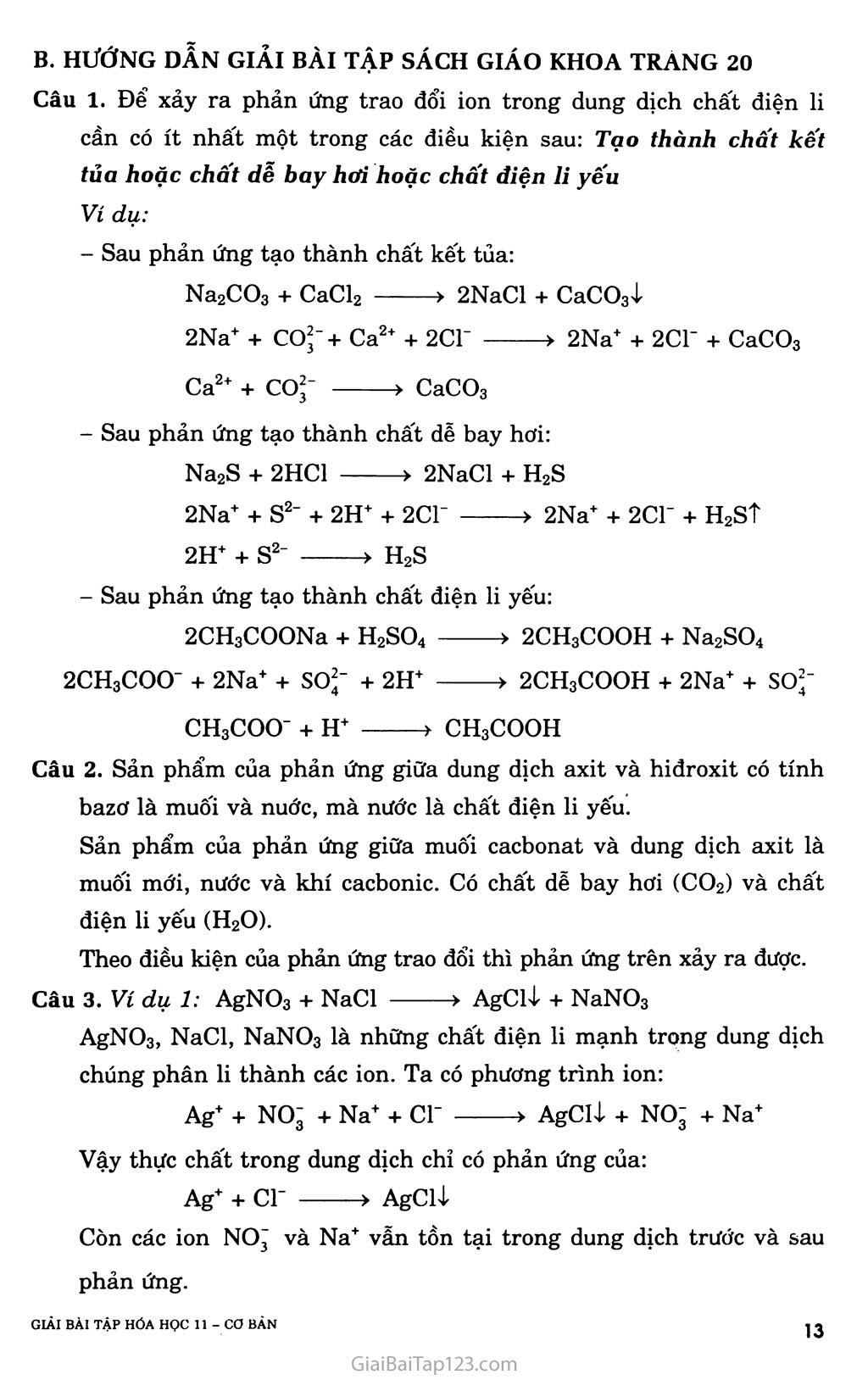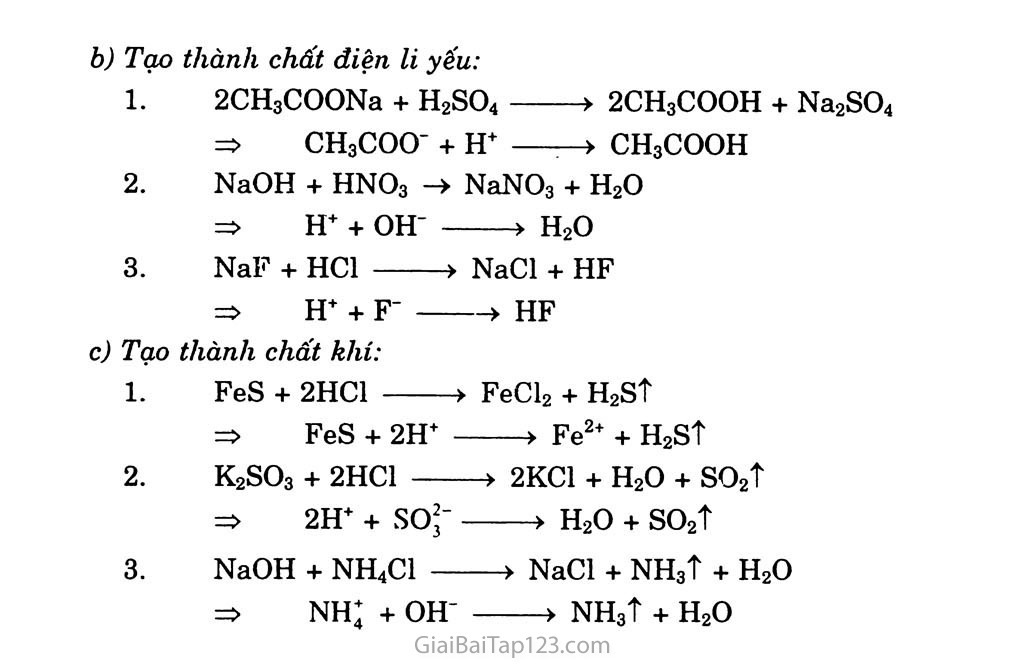Giải Hóa 11 - Bài 4: Phản ứng trao đổi ion trong dung dịch các chất điện li
BÀI 4. PHẢN ỨNG TRAO ĐÔÌ ION TRONG DUNG DỊCH CÁC CHẤT ĐIỆN LI A. KIẾN THỨC CẦN NHỚ Điều kiện xảy ra phản ứng trao đổi ion trong dung dịch các chất điện li Phản ứng tạo thành chất kết tủa Ví dụ: Na2SO4 + BaCl2 > BaSO4ị + 2NaCl Phương trình ion đầy đủ: 2Na+ + so*’ + Ba2+ + 2C1' > BaSO4ị + 2Na+ + 2CF Phương trình ion thu gọn: Ba2++ so*’ > BaSO4ị Phản ứng tạo thành chất điện li yếu Phản ứng tạo thành nước Ví dụ: HC1 + NaOH > NaCl + H2O Phương trình ion đầy đủ: H+ + cr + Na+ + OH’ > Na+ + Cl’ + H2O Phương trình ion rút gọn : H+ + OH’ > H2O. Phản ứng giữa dung dịch axit và hiđroxit có tính bazơ yếu: Mg(OH)2 rán + 2H+ > Mg2* + 2H2O,- Phản ứng tạo thành axit yếu Ví dụ: HC1 + CH3COONa > CH3COOH + NaCl. Phương trình ion đầy đủ: H+ + cr + CH3COO’ + Na+ -> CH3COOH + Na+ + Cl’ Phản ứng tạo thành chất khí Ví dụ: 2HC1 + Na2CO3 > 2NaCl + CO2T + H2O Phương trình ion đầy đủ: 2H+ + 2C1’ + 2Na+ + co*’ > 2Na+ + 2C1’ + CO2T + H2O Phương trình ion rút gọn: 2H+ + co*’ > C02T + H20 Phản ứng giữa muối cacbonat và dung dịch axit rất dễ xảy ra vì vừa tạo thành chất điện li rất yếu là H2O, vừa tạo ra chất khí co2 tách khỏi môi trường phản ứng. CaCO3 rán + 2H+ Ca2+ + co2? + H2O Kết luận Phản ứng xảy ra trong dung dịch các chất điện li là phản ứng giữa các ion. Phản ứng trao đổi ion trong dung dịch các chất điện li chỉ xảy ra khi có ít nhất một trong những điều kiện sau: Tạo thành chất kết tủa hoặcpchâít điện li yếu hoặc chất khí. B. HƯỚNG DẪN GIẢI BÀI TẬP SÁCH GIÁO KHOA TRANG 20 Câu 1. Để xảy ra phản ứng trao đổi ion trong dung dịch chất điện li cần có ít nhất một trong các điều kiện sau: Tạo thành chất kết tủa hoặc chất dễ bay hơi hoặc chất điện H yếu Ví dụ: Sau phản ứng tạo thành chất kết tủa: Na2CO3 + CaCl2 > 2NaCl + CaCO3ị 2Na+ + co2' + Ca2+ + 2CT > 2Na+ + 2CF + CaCO3 Ca2+ + CO2' > CaCO3 Sau phản ứng tạo thành chất dễ bay hơi: Na2S + 2HC1 > 2NaCl + H2S 2Na+ + s2' + 2H+ + 2C1' > 2Na+ + 2C1' + H2st 2H+ + s2' > H2S Sau phản ứng tạo thành chất điện li yếu: 2CH3COONa + H2SO4 > 2CH3COOH + Na2SO4 2CH3COO' + 2Na+ + so2' + 2H+ > 2CH3COOH + 2Na+ + so2' CH3COO' + H+ > CH3COOH Câu 2. Sản phẩm của phản ứng giữa dung dịch axit và hiđroxit có tính bazơ là muối và nuớc, mà nước là chất điện li yếu. Sản phẩm của phản ứng giữa muối cacbonat và dung dịch axit là muối mới, nước và khí cacboníc. Có chất dễ bay hơi (CO2) và chất điện li yếu (H2O). Theo điều kiện của phản ứng trao đổi thì phản ứng trên xảy ra được. Câu 3. Ví dụ 1: AgNO3 + NaCl > AgClị + NaN03 AgNO3, NaCl, NaN03 là những chất điện li mạnh trong dung dịch chúng phân li thành các ion. Ta có phương trình ion: Ag+ + NO' + Na+ + Cl' > AgCIị + NO' + Na+ Vậy thực chất trong dung dịch chỉ có phản ứng của: Ag+ + cr ——-> AgCU Còn các ion NOJ và Na+ vẫn tồn tại trong dung dịch trước và sau phản ứng. Ví dụ 2: Na2SO3 + 2HC1 > 2NaCl + so2t + H20 Phương trình ion: 2Na+ + so2’ + 2H+ + cr > 2Na+ + 2C1’ + H2O + so2t so2’ + 2H+ > H2O + so2? Vậy thực chất trong dung dịch chỉ có phản ứng của 2H+ với so2’ còn các ion Na+ và cr vẫn tồn tại trong dung dịch trước và sau phản ứng. => Thực chất phản ứng trong dung dịch điện li là phản ứng giữa các ion vì các chất điện li đã phân li thành các ion. Câu 4. Chọn c Vì chỉ rõ các ion nào đã tác dụng với nhau làm cho phản ứng xảy ra. Câu 5. a) Fe2(SO4)3 + 6NaOH > 3Na2SO4 + 2Fe(OH)3ị => Fe3+ + 3OH’ > Fe(OH)3ị NH4C1 + AgNO3 > NH4NO3 + AgClị => Ag+ + cr > AgClị NaF + HC1 > NaCl + HF => H+ + F’ > HF MgCl2 + KNO3 > không có phản ứng FeS rắn + 2HC1 > FeCl2 + H2ST => FeS rắn + 2H+ > Fe2+ + H2ST HC1O + KOH > KC1O + H2O => HC1O + OH' > H2O + C1O’ Câu 6. Chọn D Vì Fe(NO3)3 + 3K0H > Fe(OH)3ị + 3KNO3 Câu 7. Tạo thành chất kết tủa: AgNO3 + HC1 > AgClị + HNO3 => Ag+ + cr > AgCll K2SO4 + Ba(OH)2 > 2K0H + BaSO4ị => Ba2+ + so2’ > BaSOj Na2CỌ3 + MgCl2 > 2NaCl + MgCO3ị => Mg2+ + co2’ > MgCO3ị Tạo thành chất điện li yếu: 2CH3COONa + H2SO4 > 2CH3COOH + Na2SO4 => CH3C00 + H —> CH3COOH NaOH + HNO3 -> NaNO3 + H2O => H+ + OH" > H2O NaF + HC1 > NaCl + HF => H+ + F’ > HF Tạo thành chất khí: FeS + 2HC1 > FeCl2 + H2st => FeS + 2H+ > Fe2+ + H2st K2SO3 + 2HC1 > 2KC1 + H2O + so2t => 2H+ + so2’ > H2O + so2t NaOH + NH4C1 > NaCl + NH3T + H2O => NH; + OH’ > NH3T + H2O