Giải Hóa 11 - Bài 37: Phenol
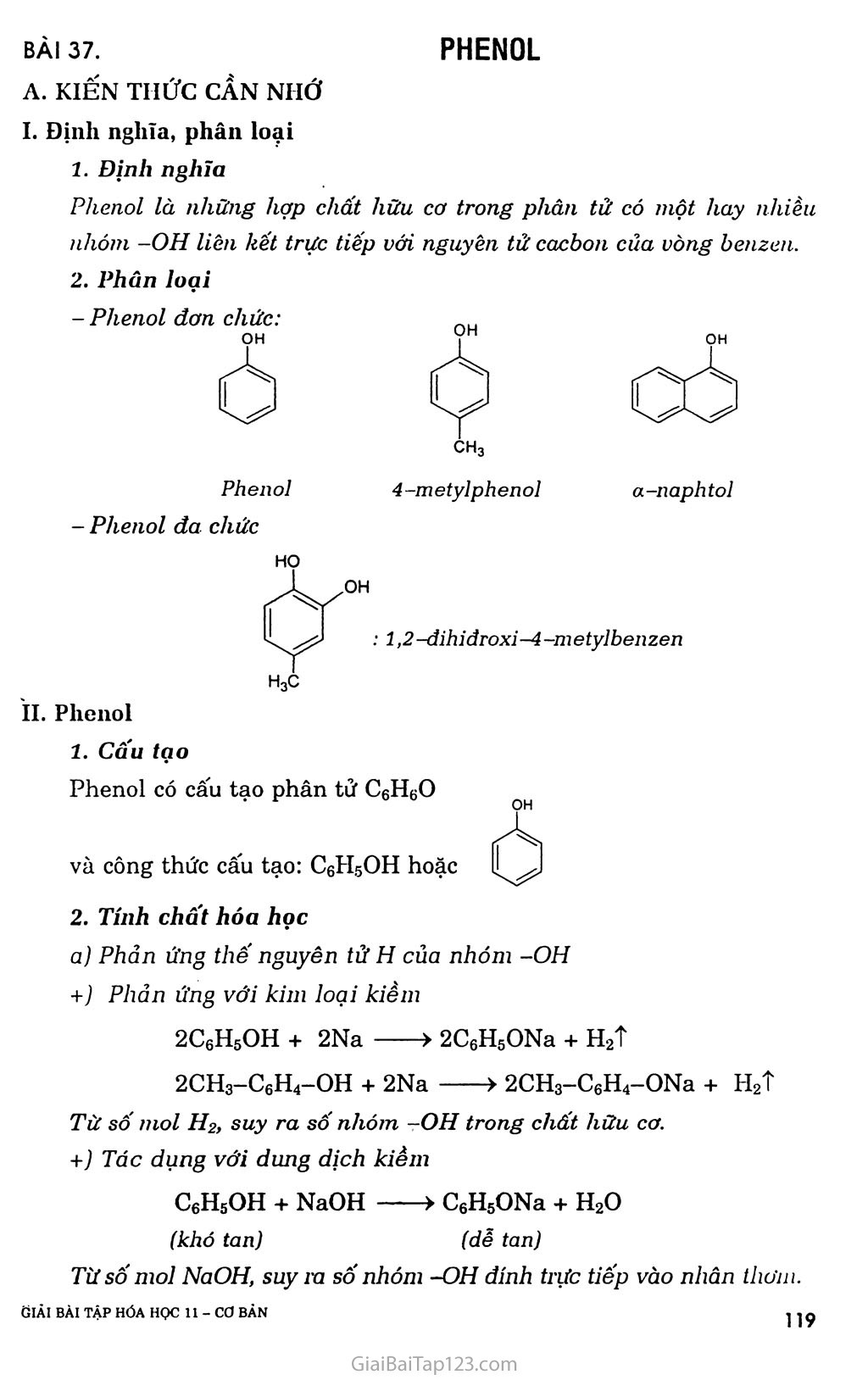
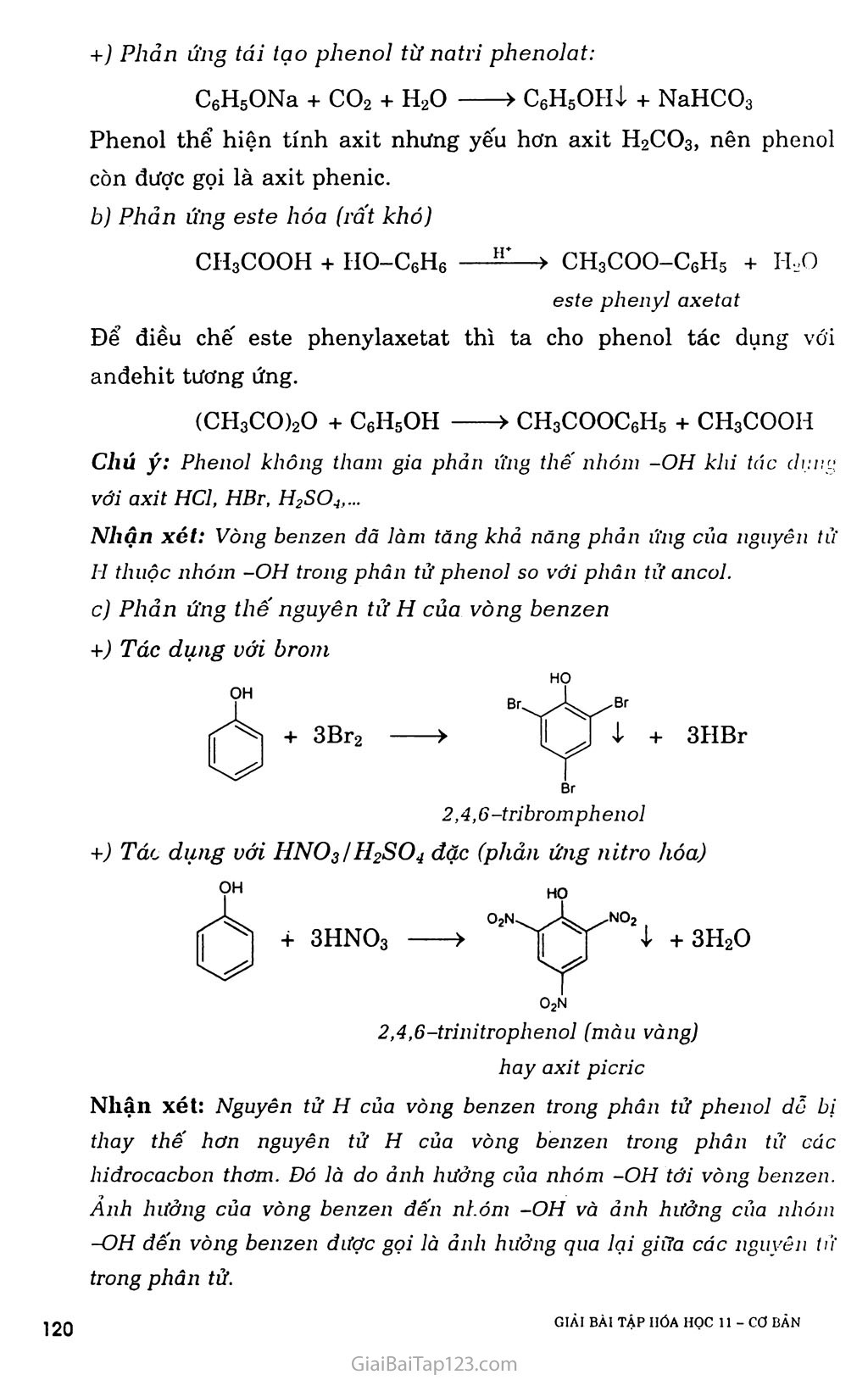
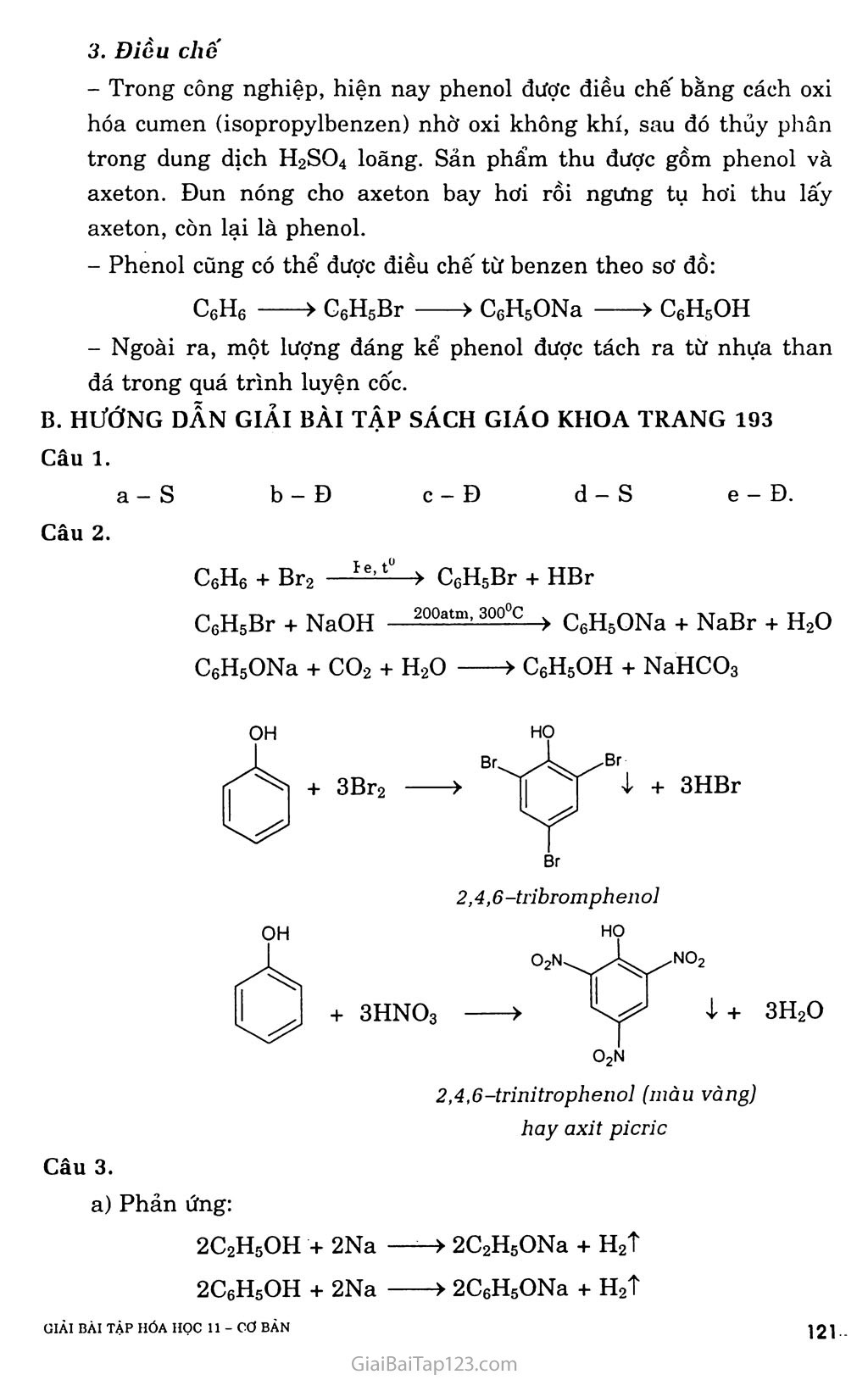
- PHENOL ch3 Phenol 4 -metylphenoỉ a-naphtol : í,2-đihiđroxi-4-metylbenzen BÀI 37. A. KIẾN THỨC CẦN NHỚ I. Định nghĩa, phân loại í. Định nghĩa Phenol là những hợp chất hữu cơ trong phân tử có một hay nhiều nhóm -OH liên kết trực tiếp với nguyên tử cacbon của vòng benzen. 2. Phân loại - Phenol đơn chức: - Phenol đa chức II. Phenol 1. Cấu tạo ỌH Phenol có cấu tạo phân tử C6H6O và công thức cấu tạo: C6H5OH hoặc lị 2. Tính chốt hóa học Phản ứng thế nguyên tử H của nhóm -OH +) Phản ứng với kim loại kiềm 2C6H5OH + 2Na > 2C6H5ONa + H2T 2CH3-C6H4-OH + 2Na > 2CH3-C6H4-ONa + H2T Từ số mol Hỉ, suy ra số nhóm -OH trong chất hữu cơ. +) Tác dụng với dung dịch kiềm C6H5OH + NaOH > C6H5ONa + H2O (khó tan) (dễ tan) Từ số moi NaOH, suy ra số nhóm -OH đính trực tiếp vào nhân thơm. tìlẢI BÀI TẬP HÓA HỌC 11 - Cơ BĂN J ì ọ +) Phản ứng tái tạo phenol từ natri phenolat: C6H5ONa + co2 + H2O > C6H5OHị + NaHCO3 Phenol thể hiện tính axit nhưng yếu hơn axit H2CO3, nên phenol còn được gọi là axit phenic. Phản ứng este hóa (rất khó) CH3COOH + HO-C6H6 Để điều chế este phenylaxetat anđehit tương ứng. —> CH3COO-C6H5 + H,0 este phenyl axe tat thì ta cho phenol tác dụng với (CH3CO)2O + C6H5OH > CH3COOC6H5 + CH3COOH Chú ý: Phenol không tham gia phản ứng thế nhóm -OH khi tác dụng với axit HC1, HBr, H2SC>4,... Nhận xét: Vòng benzen đã làm tăng khả nâng phản ứng của nguyên tử II thuộc nhóm -OH trong phân tử phenol so với phân tử ancol. c) Phản ứng thế nguyên tử H của vòng benzen +) Tác dụng với brom OH + 3Br2 Br Br ị + 3HBr HO Br 2,4,6-tribromphenol +) Tác dụng với HNO3/ỈI2SO4 dặc (phản ứng nitro hóa) OH + 3HNO3 HO O2N no2 I- + 3H2O 02n 2,4,6-trỉnitrophenol (màu vàng) hay axit picric Nhận xét: Nguyên tử H của vòng benzen trong phân tử phenol dỗ bị thay thế hơn nguyên tử H của vòng benzen trong phân tử các hỉđrocacbon thơm. Đó là do ảnh hưởng của nhóm -OH tới vòng benzen. Ảnh hưởng của vòng benzen đến nhóm -OH và ảnh hưởng của nhóm -OH đến vòng benzen được gọi là ảnh hưởng qua lại giữa các nguyên tử trong phân tử. Điều chế Trong công nghiệp, hiện nay phenol được điều chế bằng cách oxi hóa cumen (isopropylbenzen) nhờ oxi không khí, sau đó thủy phân trong dung dịch H2SO4 loãng. Sản phẩm thu được gồm phenol và axeton. Đun nóng cho axeton bay hơi rồi ngưng tụ hơi thu lấy axeton, còn lại là phenol. Phenol cũng có thể được điều chế từ benzen theo sơ đồ: - Ngoài ra, một lượng đáng kế’ phenol được tách ra từ nhựa than đá trong quá trình luyện cốc. C6H6 > G6H5Br > C6H5ONa > C6H5OH B. HƯỚNG DẪN GIẢI BÀI TẬP SÁCH GIÁO KHOA TRANG 193 Câu 1. a- s c- Đ d- s e - Đ. Câu 2. C6H6 + Br2 — C6H6 + Br2 e, t -> C6H5Br + HBr C6H5Br + NaOH 200atm- 300°c-> C6H5ONa + NaBr + H2O C6H5ONa + co2 + H2O > C6H5OH + NaHCO3 OH HỌ > Br. Br ị + 3HBr OH Br 2,4,6 -tribrom phenol HỌ O2N 2,4.6-trinitrophenol (màu vàng) hay axit picric Câu 3. a) Phản ứng: 2C2H5OH + 2Na ——> 2C2H5ONa + H2T 2C6H5OH + 2Na > 2C6H5ONa + H2T Gọi X, y là số mol của etanol và phenol trong hỗn hợp ban đầu. Theo đề bài, ta cố hệ phương trình: mA = 46x + 94y = 14 1 _ X y 2,24 n,, = 77 + ị- = 7^7— [ H’ 2 2 22,4 Giải hệ phương trình, ta được: X = y = 0,1 (mol). Vậy: = °’1!*46 X 100 = 32.9%■ %mc6H5OH = 100% - 32,9% = 67.1% Phản ứng: C6H5OH + 3HNO3 > C6H5(NO2)3OH4- + 3H2O (1) (mol) 0,1 0,1 Từ (1) => naxit picric — 0,1 (mol) rftaxit picric = 0,1 X 229 = 22,9 (gam). Câu 4. +) Hiện tượng: nước brom nhạt màu, có kết tủa trắng xuất hiện. C6H5OH + 3Br2 > C6H2(OH)Br3ị + 3HBr +) Hiện tượng: dung dịch brom nhạt màu. C6H5-CH=CH2 + Br2 > C6H5-CHBr-CH2Br Câu 5. Phản ứng: C6H5ONa + co2 + H20 > C6H5OHị + NaHCO3 => Tính axit của phenol yếu hơn so với axit cacbonic. Câu 6. +) C6H6 + Br2 - ■> C6H5Br + HBr C6H5Br + 2NaOH ■■ 200atm-300°c > C6H5ONa + NaBr + H2O C6H5ONa + co2 + H2O > C6H5OH + NaHCO3 +) C6H5-CH2-CH3 + Cl2 > C6H5-CHC1-CH3 + HC1 C6H5-CHC1-CH3 + NaOH > C6H5-CH(OH)-CH3 + NaCl C6H5-CH(OH)-CH3 HgSOj đặc, 170°c > C6H5_CH=CH2 + H2O Hoặc C6H5-CH2-CH3 xt’t0’p > C6H5-CH=CH2