Giải Hóa 9: Bài 4. Một số axit quan trọng
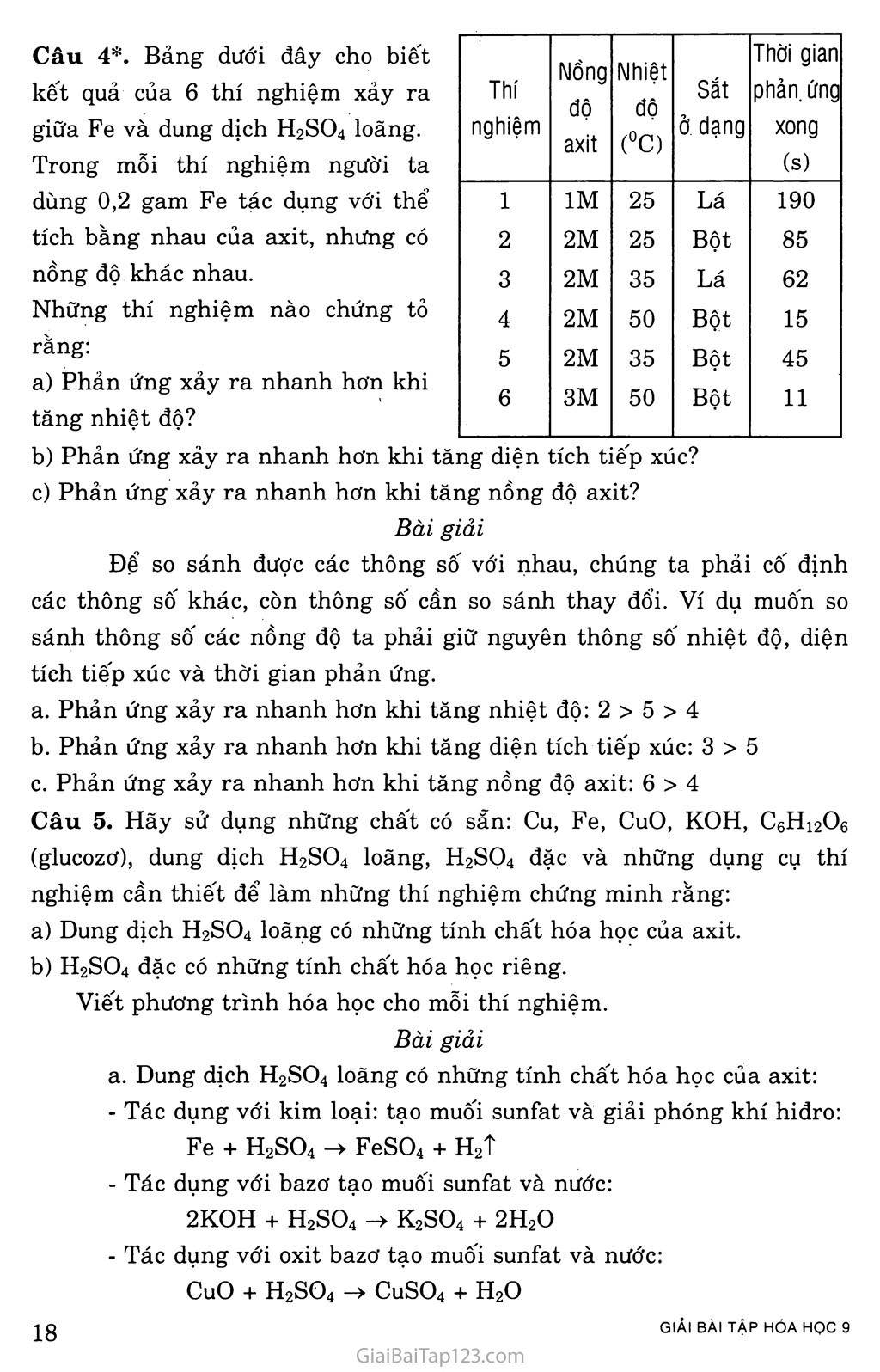
BÀI 4. MỘT SỐ AXIT QUAN TRỌNG KIẾN THỨC CẦN NAM vững AXIT CLOHIĐRIC (HCI) Làm đổi màu chất chỉ thị màu. Tác dụng với nhiều kim loại tạo thành muối clorua và giải phóng khí hiđro. 6HC1+ 2A1 -> 2AICI3 + 3H2t Tác dụng với bazơ tạo thành muối clorua và nước. HC1 + NaOH -> NaCl + H2O Tác dụng với oxit bazơ tạo thành muối clorua và nước. 2HC1 + MgO -> MgCl2 + H2O ứng dụng: + Điều chế các muối clorua + Làm sạch bề mặt kim loại trước hàn + Tẩy gỉ kim loại trước khi sơn, mạ, tráng kim loại. + Chế biến thực phẩm, dược phẩm. AXIT SUNFURIC (H2SQ4) Là chất lỏng sánh, không màu, nặng gần gấp hai lần nước, không bay hơi, tan dễ dàng trong nước và tỏa nhiệt nhiều. Axit sunfuric hút nước mạnh nên được dùng làm khô khí. H2SO4 loãng có đầy đủ tính chất hóa học của một axit thông thường: Làm đổi màu chất chỉ thị màu, tác dụng với kim loại, bazơ, oxit bazơ... H2SO4 + 2NaOH -> Na2SO4 + H2O Fe + H2SO4 -> FeSO4 + H2t MgO + H2SO4 -> MgSO4 + H2O Axit sunfuric đặc, nóng tác dụng với hầu hết các kim loại đế tạo thành muối nhưng không giải phóng hiđro. Cu + 2H2SO4đạc, nóng CuSO4 + so2t + 2H2O. Tính háo nước: H2SO4 đặc hút nước mạnh nên làm cháy các vật khi tiếp xúc. C12H22O11 HaS0^ > 12C + 11H2O c + 2H2SO4đặc -> co2t + 2SO2T + 2H2O Do khí co2, so2 sinh ra đã đẩy lượng cacbon còn lại trào ra ngoài như thí nghiệm SGK. ứng dụng: chất tẩy rửa, ắc quy, tơ sợi, giấy, phân bón... Điều chế: axit sunfuric được sản xuất trong công nghiệp bằng phương pháp tiếp xúc. 4FeS2 + 11O2 ——> 2Fe2O3 + 8SO2 2SO2 + 02 2SO3 SO3 + H2O -> H2SO4 Nhận biết axit sunfuric và muối của nó: bằng dung dịch muối bari clorua (BaCl2) hoặc bari hiđroxit (Ba(OH)2) khi gặp muối này dễ tạo thành BaSO4 kết tủa trắng. Na2SO4 + BaCl2 -> BaSO4ị + 2NaCl H2SO4 + BaCl2 -> BaSO4ị + 2HC1 GIẢI BÀI TẬP SÁCH GIÁO KHOA Câu 1. Có những chất: CuO, BaCl2, Zn, ZnO. Chất nào nói trên tác dụng với dung dịch HC1, dung dịch H2SO4 loãng sinh ra: Chất khí cháy được trong không khí? Dung dịch có màu xanh lam? Chất kết tủa màu trắng không tan trong nước và axit? Dung dịch không màu và nước? Viết tất cả các phương trình hóa học. Bài giải Sinh ra chất khí cháy được trong không khí (H2). Zn + 2HC1 -> ZnCl2 + H2O Zn + H2SO4 -> ZnSO4 + H2O Sinh ra dung dịch có màu xanh lam: CuCl2hoặc CuSO4 CuO + 2HC1 -> CuCl2 + H2O CuO + H2SO4 -> CuSO4 + H2O Sinh ra kết tủa màu trắng không tan tròng nước và axit: BaSO4 BaCl2 +H2SO4 -> BaSO4ị + 2HC1 Sinh ra dung dịch không màu và nước: ZnCl2, ZnSO4 ZnO + 2HC1 -> ZnCl2 + H20 ZnO + H2SO4 -> ZnSO4 + H20 Câu 2. Sản xuất axit sunfuric trong công nghiệp cần phải có những nguyên liệu chủ yếu nào? Hãy cho biết mục đích của mỗi công đoạn sản xuất axit sunfuric và dẫn ra những phản ứng hóa học. Bài giải Sản xuất axit sunfuric trong công nghiệp cần phải có nguyên liệu chủ yếu là lưu huỳnh (hoặc quặng pirit), không khí và nước. Giai đoạn 1: Sản xuất ra lưu huỳnh đioxit. s + 02 -íĩ-> so2 Giai đoạn 2: Sản xuất ra lưu huỳnh trioxit. 2SO2 + O2 2SO3 2 z 450° c 3 Giai đoạn 3: Sản xuất axit sunfuric. so3 + H2O -> H2SO4 Câu 3. Bằng cách nào có thể nhận biết được từng chất trong mỗi cặp chất sau theo phương pháp hóa học? Dung dịch HC1 và dung dịch H2SO4; Dung dịch NaCl và dung dịch Na2SO4. Dung dịch Na2SO4 và dung dịch H2SO4. Viết các phương trình hóa học. Bài giải Trích mẫu thử. Cho dung dịch BaCl2 vào mỗi lọ, lọ nào có kết tủa màu trắng đó chính là H2SO4, còn lọ không có hiện tượng gì là HC1. BaCl2 + H2SO4 -> BaSO4ị + 2HC1 Trích mẫu thử. Cho dung dịch BaCl2 vào mỗi lọ, lọ nào có kết tủa màu trắng đó chính là Na2SO4, không có hiện tượng gì là NaCl. BaCla + Na2SO4 -> BaSOj + 2NaCl Trích mẫu thử. Dùng quì tím để thử, nếu lọ nào làm cho quỳ tím chuyển sang màu đỏ là H2SO4, lọ còn lại là Na2SO4. Câu 4*. Bảng dưới đây cho biết kết quả của 6 thí nghiệm xảy ra giữa Fe và dung dịch H2SO4 loãng. Trong mỗi thí nghiệm người ta Thí nghiệm Nồng độ axit Nhiệt độ (°C) Sắt ở dạng Thời gian phản, ứng xong (s) dùng 0,2 gam Fe tác dụng với thể 1 IM 25 Lá 190 tích bằng nhau của axit, nhưng có 2 2M 25 Bột 85 nồng độ khác nhau. 3 2M 35 Lá 62 Những thí nghiệm nào chứng tỏ 4 2M 50 Bột 15 rằng: 5 2M 35 Bôt 45 a) Phản ứng xảy ra nhanh hơn khi tăng nhiệt độ? 6 3M 50 Bột 11 Phản ứng xảy ra nhanh hơn khi tăng diện tích tiếp xúc? Phản ứng xảy ra nhanh hơn khi tăng nồng độ axit? Bài giải Để so sánh được các thông số với nhau, chúng ta phải cố định các thông số khác, còn thông số cần so sánh thay đổi. Ví dụ muốn so sánh thông số các nồng độ ta phải giữ nguyên thông số nhiệt độ, diện tích tiếp xúc và thời gian phản ứng. Phản ứng xảy ra nhanh hơn khi tăng nhiệt độ: 2 > 5 > 4 Phản ứng xảy ra nhanh hơn khi tăng diện tích tiếp xúc: 3 > 5 Phản ứng xảy ra nhanh hơn khi tăng nồng độ axit: 6 > 4 Câu 5. Hãy sử dụng những chất có sẵn: Cu, Fe, CuO, KOH, C6H12O6 (glucozơ), dung dịch H2SO4 loãng, H2SỌ4 đặc và những dụng cụ thí nghiệm cần thiết để làm những thí nghiệm chứng minh rằng: Dung dịch H2SO4 loãng có những tính chất hóa học của axit. H2SO4 đặc có những tính chất hóa học riêng. Viết phương trình hóa học cho mỗi thí nghiệm. Bài giải a. Dung dịch H2SO4 loãng có những tính chất hóa học của axit: Tác dụng với kim loại: tạo muối sunfat và giải phóng khí hiđro: Fe + H2SO4 -> FeSO4 + H2T Tác dụng với bazơ tạo muôi sunfat và nước: 2K0H + H2SO4 -> K2SO4 + 2H2O Tác dụng với oxit bazơ tạo muôi sunfat và nước: CuO + H2SO4 -> CuSO4 + H2O H2SO4 đặc có những tính chất hóa học riêng: Tác dụng với Cu: Cu + 2H2SO4 đặc CuSO4 + so2t + 2H2O Làm chất xúc tác phân hủy đường: C12H22O„ H°S(Mặc > IIH2O + 12C Câu 6. Cho một khối lượng mạt sắt dư vào 50 ml dung dịch HC1. Phản ứng xong, thu được 3,36 lít khí (đktc). Viết phương trình hóa học; Tính khối lượng mạt sắt đã tham gia phản ứng; Tìm nồng độ mol của dung dịch HC1 đã dùng. Bài giải Phương trình hóa học: Fe + 2HC1-» FeCl2 + H2t (mol) 0,15 <- 0,3 <- 0,15 Ta có: 11H; = ^36 = 0.15 (mol) nFe = 0,15 mol -> mFe = 0,15.56 = 8,4 (gam) Ta có: nHci = 0,3 mol „ 11 _ 0,3 Cm,h“= V ĩấ ( * Câu 7*. Hòa tan hoàn toàn 12,1 gam hỗn hợp bột CuO và ZnO cần 100ml dung dịch HC1 3M. Viết các phương trình hóa học. Tính phần trăm theo khối lượng của mỗi oxit trong hỗn hợp ban đầu. Hãy tính khối lượng dung dịch H2SO4 nồng độ 20% để hòa tan hoàn toàn hỗn hợp các oxit trên. Bài giải Phương trình hóa học CuO + 2HC1 -> CuCl2 + H2O (mol) X -> 2x ZnO + 2HC1 -> ZnCl2 + H2O (mol) y -» 2y Ta có: nHci = Cm ■ V = 3. 0,1 = 0,3 (mol) Gọi X, y lần lượt là số mol của CuO, ZnO trong hỗn hợp theo đề bài, ta có hệ phương trình: 2x + 2y = 0,3 Jx = 0,05mol 80x + 8ly -12,1 y = 0,lmol mCuo = 0,05 . 80 = 4 (gam); mZno= 0,1 . 81 = 8,1 (gam) Vậy : C%(CuO) = ^y.100% = 33,°6% C%(ZnO) = ^-.100% = 66,94% CuO + H2SO4 -> CuSO4 + H2O (mol) 0,05 0,05 ZnO + H2SO4 -> ZnSO4 + H2O (mol) 0,1 0,1 nH S0 = 0,05 + 0,1 = 0,15 (mol) mH2SOj = 0,15. 98 = 14,7 (gam) mHdH co. = ^7-100% = 11^.100% = 73,5 (gam) đdH2so4 c% 20%