Giải Hóa 12: Bài 23. Kim loại kiềm thổ và hợp chất quan trọng của kim loại kiềm thổ
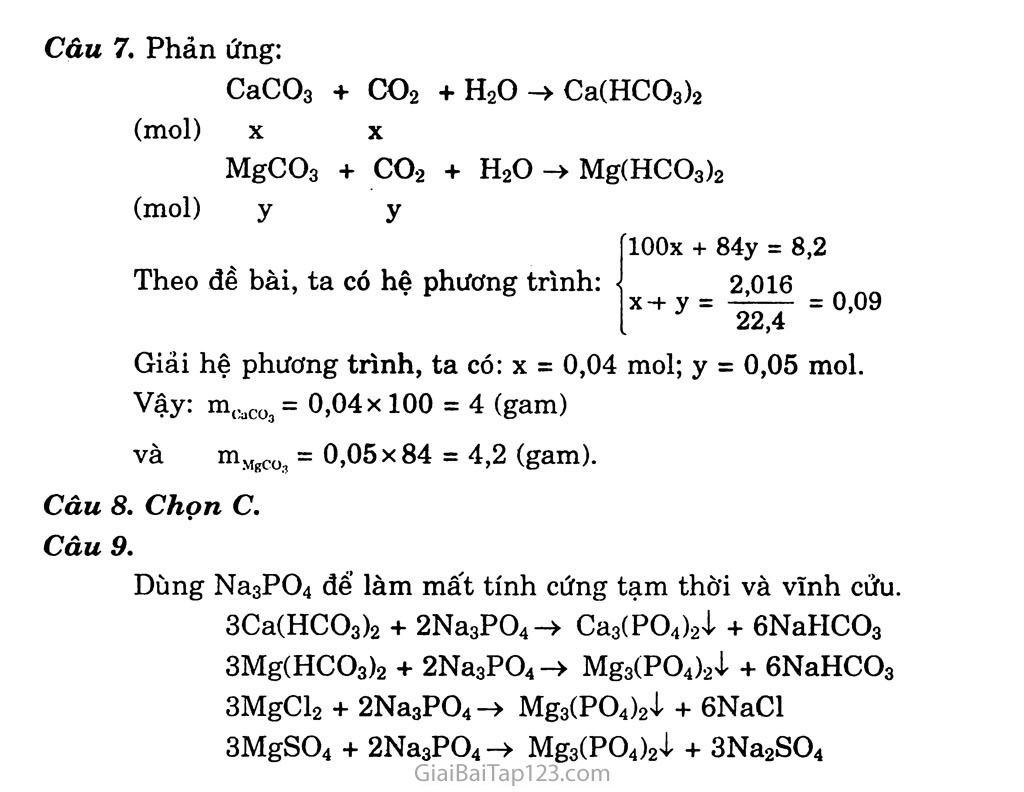
BÀI 23. KIM LOẠI KIỀM THổ VÀ HỢP CHẤT QUAN TRỌNG CỦA KIM LOẠI KIỀM THổ A. KIẾN THỨC CẦN NHỚ §1. KIM LOẠI KIỀM THỔ Tính chất hóa học Tác dụng với phi kim: 2Mg + 02 -> 2MgO Tác dụng với axit Với axit HCl, H2SO4 loãng: Mg + 2HC1 -> MgCl2 + H2T Với axit HNO3, H2SO4 đặc: 4Mg + IOHNO3 loãng -> 4Mg(NO3)2 + NH4NO3 + 3H2O 4Mg + 5H2SO4 đặc -> 4MgSỠ4 + H2sf + 4H2O 3) Tác dụng với nước: Be không khử được nước, Mg khử chậm. Các kim loại còn lại khử mạnh nước, giải phóng hiđro. Ca + 2H2O -> Ca(OH)2 + H2t §2. MỘT SỐ HỢP CHẤT QUAN TRỌNG CỦA CANXI Canxi hiđroxit Canxi hiđroxit Ca(OH)2 còn gọi là vôi tôi, là chất rắn màu trắng, ít tan trong nước. Nước vôi trong là dung dịch Ca(OH)2. Ca(OH)2 hấp thụ dễ dàng khí co2: Ca(OH)2 + co2 -> CaCO3ị + H2O Phản ứng trên thường được dùng để nhận biết khí co2. Canxi cacbonat Canxi cacbonat (CaCO3) là chất rắn, màu trắng, không tan trong nước, bị phân hủy ở nhiệt độ khoảng 1000°C. CaCO3 —£-> CaO + co2f Ở nhiệt độ thường, CaCO3 tan dần trong nước có hòa tan khí co2 tạo ra canxi hiđrocacbonat (Ca(HCO3)2), chất này chỉ tồn tại trong dung dịch. CaCO3 + co2 + H2O V—Ca(HCO3)2 Phản ứng trên giải thích sự tạo thành thạch nhũ (CaCO3) trong các hang đá vôi, cặn trong ấm nước,... Canxi sunfat Trong tự nhiên, canxi sunfat (CaSO4) tồn tại dưới dạng muối ngậm nước CaSO4.2H2O gọi là thạch cao sống. Khi đun nóng đến 160°C, thạch cao sôhg mất một phần nước biến thành thạch cao nung. CaSO4.2H2O 160°c > CaSO4.H2O + H2O thạch cao sống thạch cao nung Để điều chế thạch cao khan là CaSO4 thì người ta nung thạch cao sống ở nhiệt độ 350°C. §3. NƯỚC CỨNG 1) Khái niệm: Nước chứa nhiều ion Ca2+ và Mg2+ được gọi là nước cứng. a) Tính cứng tạm thời là tinh cứng gây nên bởi các muối Ca(ĨỈCŨ3)2 và Mg(HCOs)2 vì khi đun sôi nước tạo ra kết tủa CaCO3 và MgCO3 nên sẽ làm mất tính cứng gây ra bởi các muối này. Ca(HCO3)2 —CaCO3ị + co2f + H2O Mg(HCO3)2 —MgCCự + CO2T + H2O GIẢI BÀI TẬP HOÁ HỌC 12 - cơ BẢN Tính cứng vĩnh cửu là tính cứng gáy nên bởi các muối sunfat, clorua của canxi và magie. Tính cứng toàn phần gồm cả tính cứng tạm thời và tính cứng vĩnh cửu. Cách ỉàm mềm nước cứng Phương pháp kết tủa: Bun sôi nước, muối Ca(HCO3)2 và Mg(HCO3).2 bị phân hủy tạo ra muối cacbonat không' tan. Đề’ lắng' nước, gạn bỏ kết tủa được nước mềm. Dùng Ca(OH)2 với lượng vừa đủ để trung hòa muối axit, tạo ra kết tủa, làm mất tính cứng tạm thời. Ca(HCO3)2 + Ca(OH)2-> 2CaCO3ị + 2H2O Dùng Na2CO3 (hoặc Na3PO4) để làm mất tính cứng tạm thời và tính cứng vĩnh cửu. Ca(HCO3)2 + Na2CO3-> CaCO3ị + 2NaHCO3 CaSO4 + Na2CO3 -» CaCO3ị + Na2SO4 Phương pháp trao đổi ion: Những vật liệu vô cơ và hữu co' có khả năng trao đổi một số ion có trong thành phần cấu tạo của chúng với các ion có trong dung dịch được gọi là vật liệu trao đổi ion. Nhận biết ion Ca2+ và Mg2* trong dung dịch Dùng dung dịch muối chứa cck sẽ tạo kết tủa CaCO3 hoặc MgCO3. Sục khí co2 dư vào dung dịch, nếu kết tủa tan chứng tỏ sự có mặt của Ca2+ hoặc Mg2+ trong dung dịch ban đầu. Ca2+ + CO’- -> CaCO3ị CaCO3 + co2 + H2O -> Ca(HCO3)2 (tan) Mg2+ + cơ( -> MgCO3ị MgCO3 + CO2 + H2O —> Mg(HCO3)-2 (tan) B, HƯỚNG DẪN GIẢI VÀ ĐÁP ÁN BÀI TẬP SGK TRANG 118 - 119 Câu 1. Chọn B. Câu 2. Chọn A.. Câu 3. Chọn B. Phản ứng: CaCO3 + 2HC1 -> CaCl2 + co2? + H2O (mol) X X MgCO3 + 2HC1 -> MgCl2 + CO2t + H2O (moi) y y mu.. X- 'Vô _v.x-x-_ x_v_v. flOOx + 84y = 2,84 Theo đề bài, ta có hệ phương trình: ( „ ' [X + y = 0,03 Giải hệ phương trình, ta được: X = 0,02; y = 0,01. Vậy: %me0CO3 = X 100% = 70,4% và %mMgC03 = 100% - 70,4% = 29,6%. Câu 4. Chọn c. Gọi kim loại hóa trị II là M và nguyên tử khối của nó cũng là M. Phản ứng: M + 2HC1 -> MC12 + H2t (gam) M (M + 71) (gam) 2 5,55 Theo đề, ta có phương trình: 2(M + 71) = 5,55M Giải phương trình, ta được: M = 40: Canxi (Ca). Câu 5. Ta có : ncao = = 0,05 (mol) và nco = = 0,075 (mol). Vậy khi đun nóng, khối lượng kết tủa thu được tối đa là 5 gam. Câu 6. Gọi số mol muối MC12 là a, ta có: (M + 124).a - (M + 71).a = 7,95 (gam) => a = 0,15 (mol) Mmc,2 = Ì4’25- = 95 (g/mol) =>M = 95-71 = 24 (gam): Magie (Mg). 0,15 Câu 7. Phản ứng: CaCO3 + co2 + H20-> Ca(HCO3)2 (mol) X (mol) y lOOx + 84y = 8,2 MgCOg + co2 + H2O-> Mg(HCO3)2 Theo đề bài, ta có hệ phương trình: • Giải hệ phương trình, ta có: X = 0,04 mol; y = 0,05 mol. Vậy: m<:aC03 = 0.04 X 100 = 4 (gam) và mMgco3 = 0,05 X 84 = 4,2 (gam). Câu 8. Chọn c. Câu 9. Dùng Na3PO4 đế’ làm mất tính cứng tạm thời và vĩnh cửu. 3Ca(HCO3)2 + 2Na3PO4-> Ca3(PO4)2ị + 6NaHCO3 3Mg(HCO3)2 + 2Na3PO4-> Mg3(PO4)2ị + 6NaHCO3 3MgCl2 + 2Na3PO4-> Mg3(PO4)2ị + 6NaCl 3MgSO4 + 2Na3PO4 —> Mg3(PO4)24- + 3Na2SO4