Giải bài tập Hóa 11 Bài 1: Sự điện ly
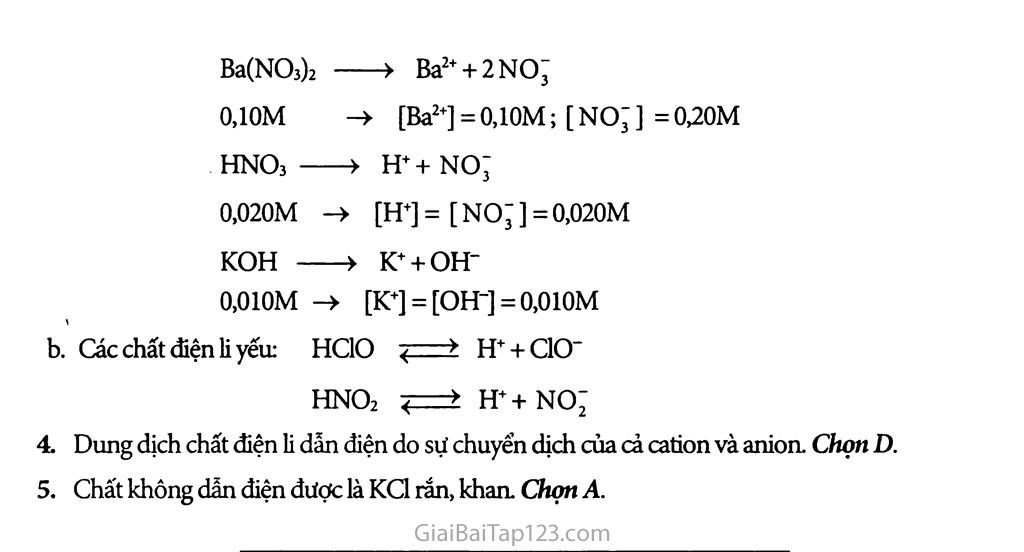
Bài 1 : Sự điện li Quá trình phâii li các chất trong nước tạo ra ion là sự điện li Tất cả các chất đều ít nhiều tan trong nước Thí dụ: Ở 25°c độ hòa tan của AgCl là 1,2.10'5 mol/1 còn của Fe(OH) 2 là 5,8. lơ6 mol/1 Chất điện li yếu trong dung dịch cân bàng động: Thi dụ : CH3COOH CH3COO- + H+ Tên gọi: * ion dương = cation ion âm = anion C2H5OH : ancol etylic C3H5(OH)3 : glixerol BÀĨ TẬP: Các dung dịch axit như HC1, bazơ như NaOH và muối như NaCI dẫn điện được, còn các dung dịch như ancol etylic, saccarozơ, glixerol không dẫn điện là do nguyên nhân gì? Sự điện li, chất điện li là gì? Những loại chất nào là chất điện li? Thế nào là chất điện li mạnh, chất điện li yếu? Lấy thí dụ và viết phương trình điện li của chúng. Viết phương trình điện li của những chất sau: Các chất điện li mạnh: Ba(NCb)2 0,1 OM; HNCb 0,020M; KOH 0,01 OM. Tính nồng độ mol cùa từng ion trong các dung dịch trên. Các chất điện li yếu: HC1O, HNƠ2. Chọn câu trả lời đúng trong các câu sau đáy: Dung dịch chất điện li dẫn điện được là do sự chuyển dịch của các electron. sự chuyển dịch của các cation. c. sự chuyển dịch của các phân từ hòa tan. D. sự chuyển dịch của cả cation và anion. Chất nào sau đây không dẫn điện được? KC1 rắn, khan. c. NaOH nóng chảy. CaCh nóng chảy. D. HBr hòa tan trong nước. HƯỚNG DẲN GIẢI: Các dung dịch axit như HC1, bazơ như NaOH và muối như NaCl dẫn điện được là do các dung dịch này có chứa các tiểu phân mang điện tích chuyển động tự do gọi là ion. Còn các dung dịch như ancol etylic, saccarozơ, glixerol không dẫn điện vì không chứa các tiểu phân mang điện tích. Sự điện li là quá tình phân li các chất trong nước ra ion. Chất điện li là các chất tan trong nước và phân li ra ion. Những chất axit, bazơ và muối là những chất điện lí Chất điện li mạnh là chất khi tan trong nước, các phân tử hòa tan đều phân li ra ion. Thí dụ: HC1—» H+ + C1’ Chất điện li yếu là chất khi tan trong nước chỉ có 1 phần số phân tử hòa tan phân li ra ion, phần còn lại vẫn tổn tại dưới dạng phân tử trong dung dịch. Thí dụ: CH3COOH CHjCOO" + H+. Phương trình điện li của những chất sau: Các chất điện li mạnh: Ba(NO3)2 0,10M > Ba2+ + 2NO; -> [Ba2+] = O,1OM; [ no; ] = 0,20iM HNOj > H++ no; 0.020M -> [H+] = [ no; ] = 0.020M KOH > K+ + OH“ 0.010M -> [K+] = [OH-] = 0,010M Các chất điện li yếư HC1O H+ + C1O- HNO2 H++NO; Dung dịch chất điện li dẫn điện do sự chuyển dịch của cả cation và anion. Chọn D. Chất không dẫn điện được là KC1 rắn, khan. Chọn A.