Giải bài tập Hóa 11 Bài 39: Dẫn xuất halogen của hiđrocacbon
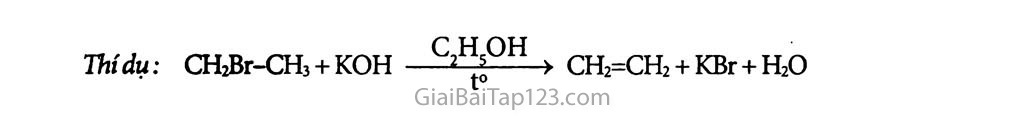
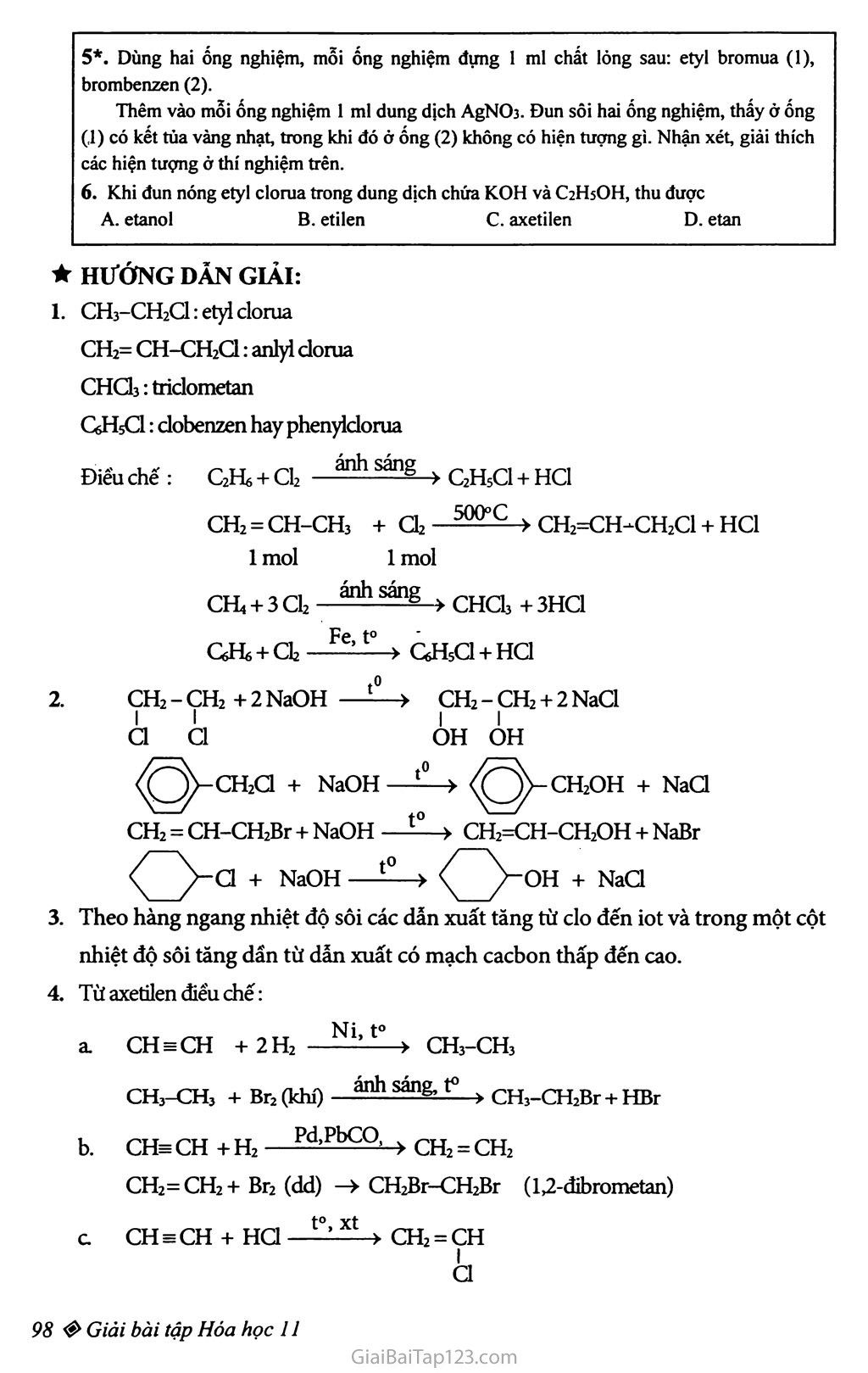
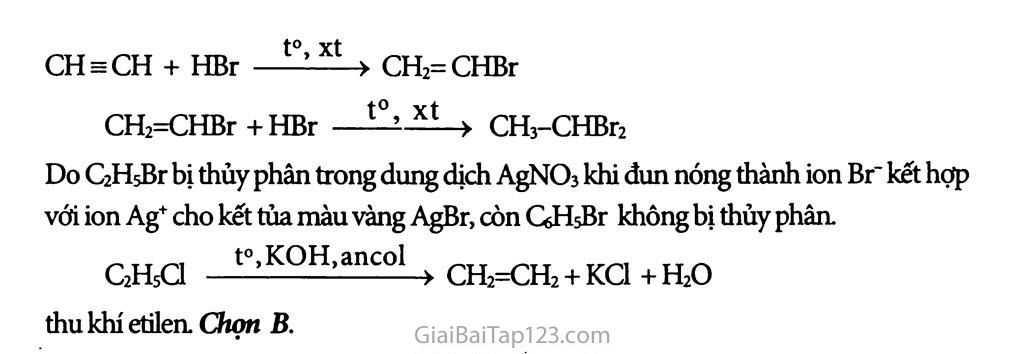
Chương 8. DẪN XUẤT HALOGEN - ANCOL - PHENOL Bài 39 : Dẩn xuất halogen của hiđrocacbon Dần xuất halogen của hiđrocacbon là các chất hữu cơ có được khi thay H của hiđrocacbon bằng nguyên tử halogen. Bậc của dẫn xuất halogen là bậc của c liên kết với halogen. Phản ứng hóa học: Phản ứng thế nguyên tử halogen bằng nhóm -OH. RX + NaOH—» R-OH + NaX b) Phản ứng tách: Tách hiđro halogenua Thí dụ: CH2Br-CHj + KOH > CH2=CH2 + KBr + H2O BÀI TẬP: _ Gọi tên mỗi chất sau: CH3-CH2C1; CH2=CH-CH2C1; CHCh; CeHsCl. Viết phương trình hóa học cùa các phản ứng điều chế mỗi chất trên từ hiđrocacbon tương ứng. Viết phương trình hóa học của phàn ứng thủy phân các chất sau trong dung dịch NaOH: 1,2-đicloetan ; benzyl clorua ; anlyl bromua ; xiclohexyl clorua. Cho nhiệt độ sôi (°C) của một số dẫn xuất halogen trong bảng dưới đây: X C1 Br I CH3-X -24 4 42 CH3CH2-X 12 38 72 ch3ch2ch2-xc 47 71 102 CH3CH2CH2CH2-X 78 102 131 Nhận xét vè sự biến đổi nhiệt độ sôi theo chiều tăng mạch cacbon (theo hàng dọc) và theo nguyên tử khối cùa halogen (hàng ngang). Giải thích sơ bộ. Từ axetilen, viết phương trình hóa học của các phản ứng điều chế: etyl bromua (1); 1,2-đibrometan (2); vinyl clorua (3); 1,1-đibrometan (4). 5*. Dùng hai ống nghiệm, mỗi ống nghiệm đựng 1 ml chất lòng sau: etyl bromua (1), brombenzen (2). Thêm vào mỗi ống nghiệm 1 ml dung dịch AgNCb. Đun sôi hai ống nghiệm, thấy ở ống (1) có kết tủa vàng nhạt, trong khi đó ở ống (2) không có hiện tượng gì. Nhận xét, giải thích các hiện tượng ờ thí nghiệm trên. Khi đun nóng etyl clorua trong dung dịch chứa KOH và C2H5OH, thu được A. etanol B. etilen c. axetilen D. etan ★ HƯỚNG DẪN GIẢI: CH3-CH2CI: etyl cloma CH2= CH-CH2C1: anlyỉ dorua CHƠ3: triclometan GHsCl: clobenzen hay phenyiclorua Điếu chế : C2Hs + Cl2 —^sáng > C2H5CI + HC1 ch2=ch-ch3 + Ơ2 - 5000(2 > CH2=CH-CH2C1 + HC1 1 mol 1 mol CHị + 3 CỈ2 .-.árásáng » CHCh + 3HC1 Qự, + CI2 —-e’t0 > GHsCl + HC1 CH2 - CH2 + 2 NaOH t0 > CH2 - CH2 + 2 NaCl I I I I C1 Cl OH ÓH -CH2C1 + NaOH t0 > -CH2OH + NaCl CH2 = CH-CH2Br + NaOH t0 > CH2=CH-CH2OH + NaBr C1 + NaOH —+ NaCl Theo hàng ngang nhiệt độ sôi các dẫn xuất tăng từ clo đến iot và trong một cột nhiệt độ sôi tăng dấn từ dẫn xuất có mạch cacbon thấp đến cao. Từ axetilen điểu chế: CH3CH +2H2 Ni’to > CH3-CH3 CH3-CH3 + Br2(khí) ánhsáttg, t° ) CH3-CH2Br + HBr CHs CH + H2 —^bCQ’ > CH2 = CH2 CH2=CH2+ Br2 (dd) —> CH2Br-CH2Br (1,2-đibrometan) c CH3CH + HC1 to,xt > CH2 = CH I à d. CH EE CH + HBr to’xt > CH2=CHBr CH2=CHBr+HBr - xt > CH3-CHBr2 Do C2HsBr bị thủy phân trong dung dịch AgNO3 khi đun nóng thành ion Br' kết hợp với ion Ag+ cho kết tủa màu vàng AgBr, còn CóHsBr không bị thủy phân. C2H5C1 t0’KQH’anco1 > CH2=CH2 + KC1+H2O thu khí etilen. Chọn B.