Giải bài tập Hóa 11 Bài 2: Axit, bazơ và muối
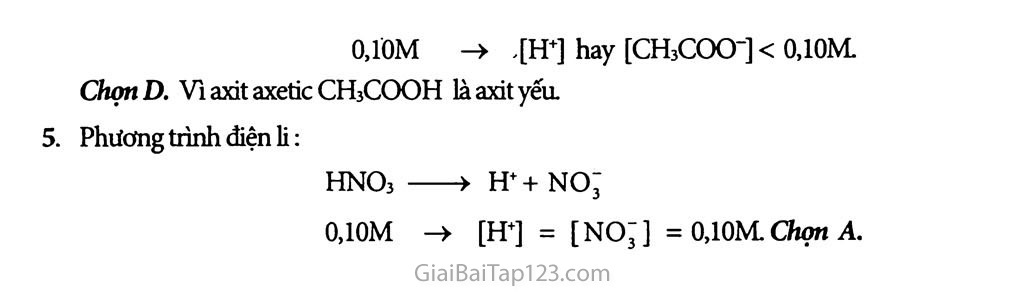
Bài 2 : Axit - Bazơ - Muối 1. H3PO4 là axit ba nấc; trong nước nó phân li ba nấc sau đây: H3PO4 h++h2po; h2po; H++ HPO4" HPOf H++ PO3f 2. Hiđroxit lưỡng tính: Zn(OH) 2; Al(OH) 3, ngoài ra còn có Sn(OH) 2; Pb(OH) 2. Chúng đểu ít tan trong nước, có lực axit và lực bazơ đều yếu. Ghi nhớ: Zn(OH)24 Zn(OH)2 Al(OH)j? A1(OH)3? :Zn2+ + 2OH- ±ZnO2 +2H+ ỉAF + 30H- A1O’ +H+ + H2O Phânlykiểubazơ Phân ly kiểu axit Phân ly kiểu bazơ Phân ly kiểu axit A1(OH)3 hay H2O.HAIO2 - axit meta-aluminic 3. Muối axit là muối còn có chứa H trong phân tử, mà H đó có thể thay thế được bằng kim loại Thí dụ: muối axit NaHCO3, NaHSO4 Tuy nhiên Na2HPO3 còn chứa H nhưng không là muối axit vì H không-thay được bằng kim loại, đo công thức cấu tạo sau: / O-Na O = P-O-Na BÀI TẬP: Phát biểu các định nghĩa axit, axit một nấc và nhiều nấc, bazơ, hiđroxit lưỡng tính, muối trung hòa, muối axit. Lấy các thí dụ minh họa và viết phương trình điện li cùa chúng. Viết phương trình điện li của các chất sau: các axit yếu: H2S, H2CO3. bazơ mạnh: LiOH. các muối: K2CO3, NaClO, NaHS. hiđroxit lưỡng tính: Sn(OH)2. Theo thuyết A-rẽ-ni-ut, kết luận nào sau đây là đúng? Một hợp chất trong thành phần phân tử có hiđro là axit. Một hợp chất trong thành phần phân tử có nhóm OH là bazơ. c. Một hợp chất có khả năng phân li ra cation H+ trong nước là axit. D. Một bazơ không nhất thiết phải có nhóm OH trong thành phần phân từ. Đoi với dung dịch axit yeu CH3COOH 0,1 OM, nếu bỏ qua sự điện li của nước thì đánh giá nào về nồng độ mol ion sau đây là đúng? [H+] = 0,1 OM c. [H+] > [CH3COO-] [H+] < [CH3COO-] D. [H+í < 0,1 OM. Đối với dung dịch axit mạnh HNO3 0,1 OM, nếu bỏ qua sự điện li của nước thì đánh giá nào về nồng độ mol ion sau đây là đúng? [H+]=0,10M c. [H+]>[NO;i [H+l<[NOjl D. [H+] <0,1 OM. HƯỚNG DẲN GIẢI: Định nghĩa: Axit: Theo thuyết Arrhenius, axit là chất khi tan trong nước phân li ra cation H+. Axit một nấc: là chất khi tan trong nước thì mỗi phân tử phân li ra một ion H+. Thí dụ: HC1 > H+ + CT. Axit nhiều nấc: là chất khi tan trong nước thì mỗi phân tử phân li ra nhiếu ion H+. • hay H2SO4 —> 2H++ so2’ Thí dụ: H2SO4->H+ + HSO; HSO; —>H++ so2’. Bazơ: Theo thuyết Arrhenius, bazơ là chất khi tan trong nước phân li ra anion OH". Hiđroxit lưỡng tính: Hiđroxit lưỡng tính là hiđroxit khi tan trong nước vừa có thể phân li như axit, vừa có thể phân li như bazơ. Thí dụ: Zn(OH)2 Zn2+ + 2OH-(tínhbazơ) Zn(OH)2 ZnO2’ + 2H+ (tínhaãt) Muối trung hòa: Muối trung hòa là muối mà anion axit không còn hiđro có khả năng phân li ra ion H+. Thí dụ: NaCl, Na2CO3, Na2HPO3 / ONa vì công thức cấu tạo của Na2HPO3 là o = p ỵONa H Muối axit: Muối axit là muối mà anion axit vẫn còn hiđro có khả năng phân li ra H+. Thí dụ: NaHCO3 >H+ + Na++CO2’ NaHCO3 > Na++ HCO; HCO; > H++ co2’. Viết phương trình điện li: a Cácaxityéu: H2S H+ + HS“ HS’ <^3 ỈT + S2-. Tương tự đối với H2CO3. Bazơmạnh: LiOH -> LP + OH’ Các muối: K2CO3 — -> 2K++CO2’ NaClO —> Na+ + C10’ NaHS Na+ + HS- HS~ <_ -> H+ + S2. d. Hiđroxit lưỡng tính: Sn(OH)2 Sn2+ + 2OH H2SnO2 SnO2’ +2H+ Theo thuyết Arrhenius, kết luận đúng là: Một hợp chất có khả năng phân li ra cation H+ trong nước là axit Chọn c. Phương trình điện li: CH3COOH CH3COO" + H+ 0.10M -> [H+] hay [CH3CO<r]< 0.10M ChọttD. Vì axit axetic CH3COOH làaxityếu. Phương trinh điện li: HNO3 > H++ no; O.1OM -» [H+] = [NO;] = O,1OM.Chọn A.