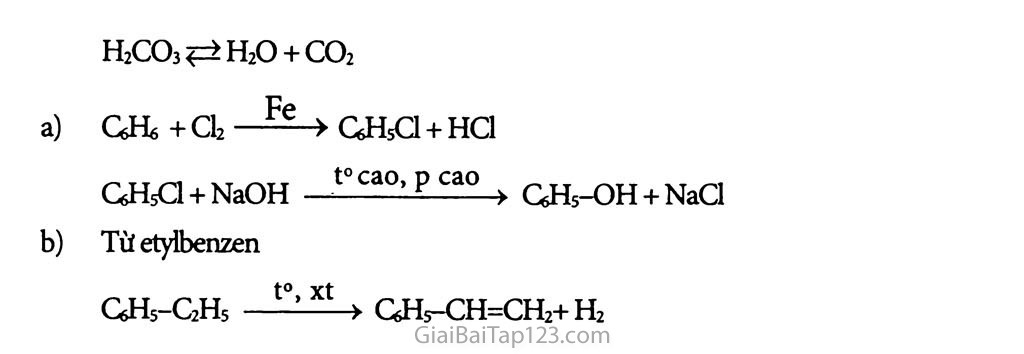Giải bài tập Hóa 11 Bài 41: Phenol
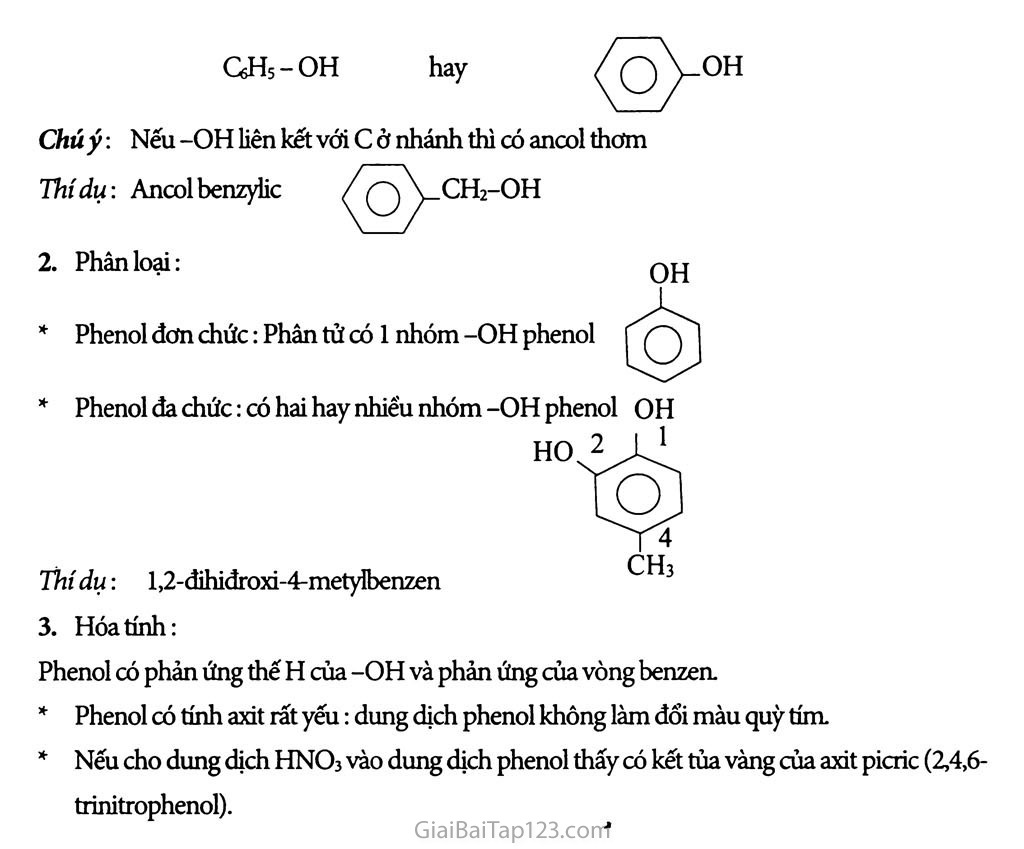
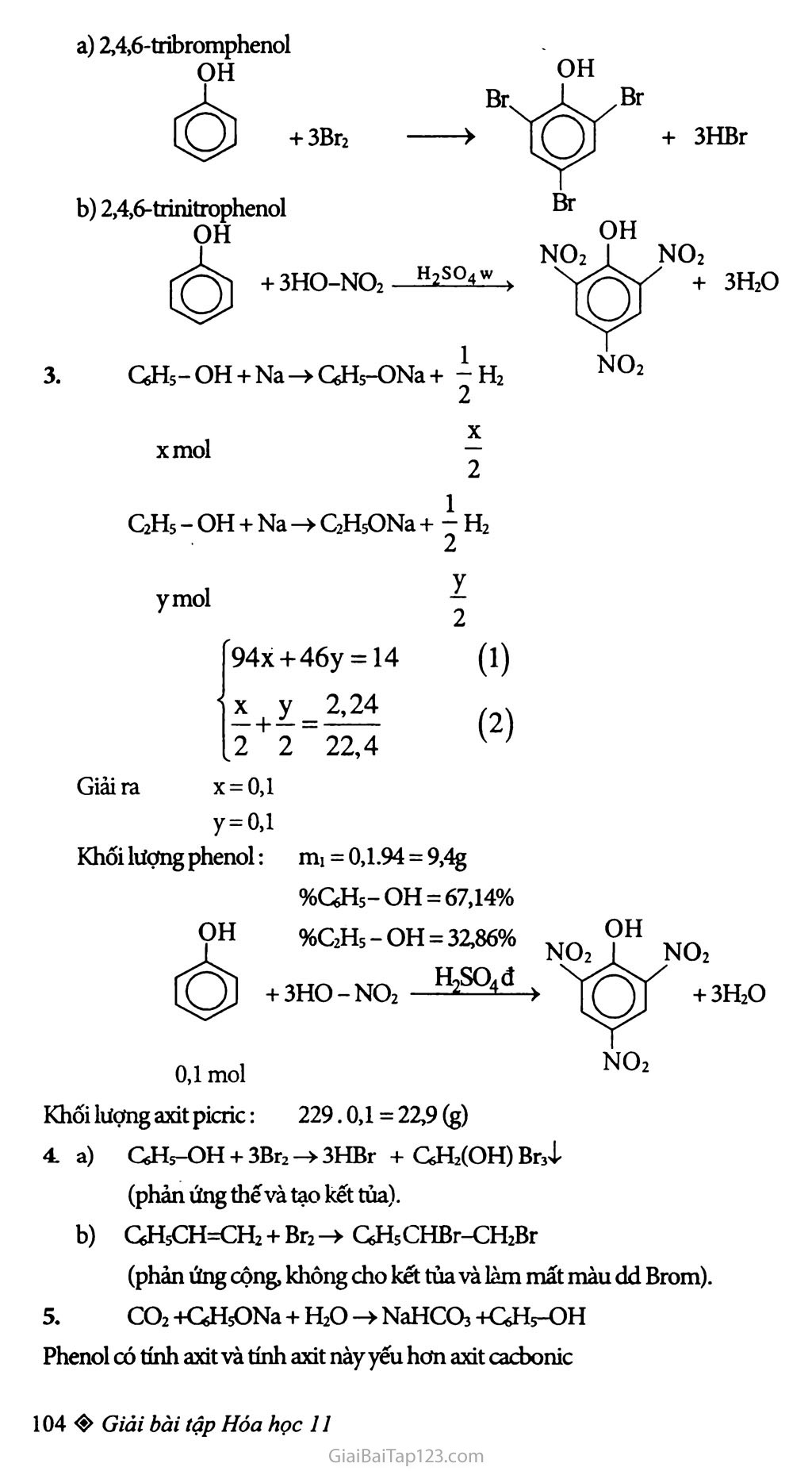
Bài 41 : Phenol Phenol là các hợp chất hữu cơ mà trong phân tử của nó có một hay nhiểu nhóm hiđroxyì liên kết trực tiếp nguyên tử c của vòng benzen. Chất đơn giản nhát có tên trùng với tên của dãy đổng đẳng đó là chất phenoL ‘ GHs-OH hay / VOH Chú ý: Nếu -OH liên kết với c ở nhánh thì có ancol thơm 77íí dụ: Ancol benzylic ^'q\>_CH2-OH Phân loại: OH Phenol đơn chức: Phân tử có 1 nhóm -OH phenol Phenol đa chức: có hai hay nhiêu nhóm -OH phenol OH HO.2 1 1 Thí dụ: l,2-đihiđroxi-4-metyỉbenzen Hóa tính: Phenol có phản ứng thế H của -OH và phản ứng của vòng benzen. Phenol có tính axit rất yếu: dung dịch phenol không làm đổi màu quỳ tím. Nếu cho dung dịch HNO3 vào dung dịch phenol thấy có kết tủa vàng của axit picric (2,4,6- trinitrophenol). ★ BÀI TẬP: □ □ □ □ Ghi Đ (đúng) hoặc s (sai) vào ô trống bên cạnh các câu sau: Phenol CéHỉ-OH là một rượu thơm. Phenol tác dụng được với natri hiđroxit tạo thành muối và nước. Phenol tham gia phản ứng thế brom và thế nitro dễ hơn benzen. Dung dịch phenol làm quỳ tím hóa đò do nó là axit. Giữa nhóm -OH và vòng benzen trong phân tử phenol có ảnh hưởng qua lại lẫn nhau. Từ phenol và các chất vô cơ cần thiết có thề điều chế được các chất sau: 2,4,6- tribromphenol (1) ; 2,4,6-trinitrophenol (2). Cho 14,0 gam hỗn hợp A gồm phenol và etanol tác dụng với natri dư thu được 2,24 lít khí hiđro (đktc). Viết các phương trình hóa học của các phản ứng xảy ra. Tính thành phần phần trăm khối lượng của mỗi chất trong A. Cho 14,0 gam hỗn hợp A tác dụng với dung dịch HNO3 (đủ) thì thu được bao nhiêu gam axit picric (2,4,6-trinitrophenol)? Cho từ từ phenol vào nước brom (1) ; stiren vào dung dịch brom trong ccu (2). Nêu hiện tượng và viết các phương trình hóa học. Sục khí CO2 vào dung dịch natri phenolat thấy dung dịch bị vẩn đục, trong dung dịch có NaHCCb được tạo thành. Viết phương trình hóa học của phàn ứng xảy ra và giải thích. Nhận xét về tính axit cùa phenol. Viết các phương trình hóa học điều chế: phenol từ benzen (1), stiren từ etylbenzen (2). Các chất vô cơ càn thiết coi như có đủ. e)Đ ★ HƯỚNG DÂN GIẢI: a)S b)Đ c)Đ d)S Từ phenol điểu chế: a) 2,4,6-tribromphenol OH + 3Br2 b) 2,4,6-trinitrophenol OH OH + 3HO-NO2 ■ h2s°4w ) CsHs-OH + Na—»CfiH5-ONa + tH2 2 OH NO2 1 NO2 + 3H2O xmol C2H5 - OH + Na -4- C2H5ONa + 7 H2 2 (1) (4 ymol Giảira 94x + 46y = 14 X y _2,24 .2 2 _ 22,4 x = o,l y=o,l Khối lượng phenol: mi = 0,1.94 = 9,4g %GHs-OH = 67,14% OH %&Hi-OH = 3i86% OH (ộ) + 3HO-NO, -B£°1d > + 3H2O 0,1 mol NO2 Khối lượng axit picric: 229.0,1 = 22,9 (g) a) CsHs-OH + 3Br2 -> 3HBr + GHXOH) Br3ị (phản ứng thế và tạo kết tủa), b) C6H5CH=CH2 + Br2 -> GHsCHBr-OhBr (phản ứng cộng, không cho kết tủa và làm mất màu dd Brom). CO2+C6H5ONa + H2O->NaHCO3+G6H5-OH Phenol có tính axit và tính axit này yếu hơn axit cacbonic H2CO3?=>H2O + CO2 6. a) CfrHfi + Cl2 Fe > GHsCl + HCl CfiHsCl + NaOH — t°C-0’ p cao ■■> QHs-OH + NaCl b) Từ etyibenzen t°, xt QHs-CzHs -> GH5-CH=CH2+H2