Giải bài tập Hóa 11 Bài 19: Luyện tập: Tính chất của cacbon, silic và các hợp chất của chúng
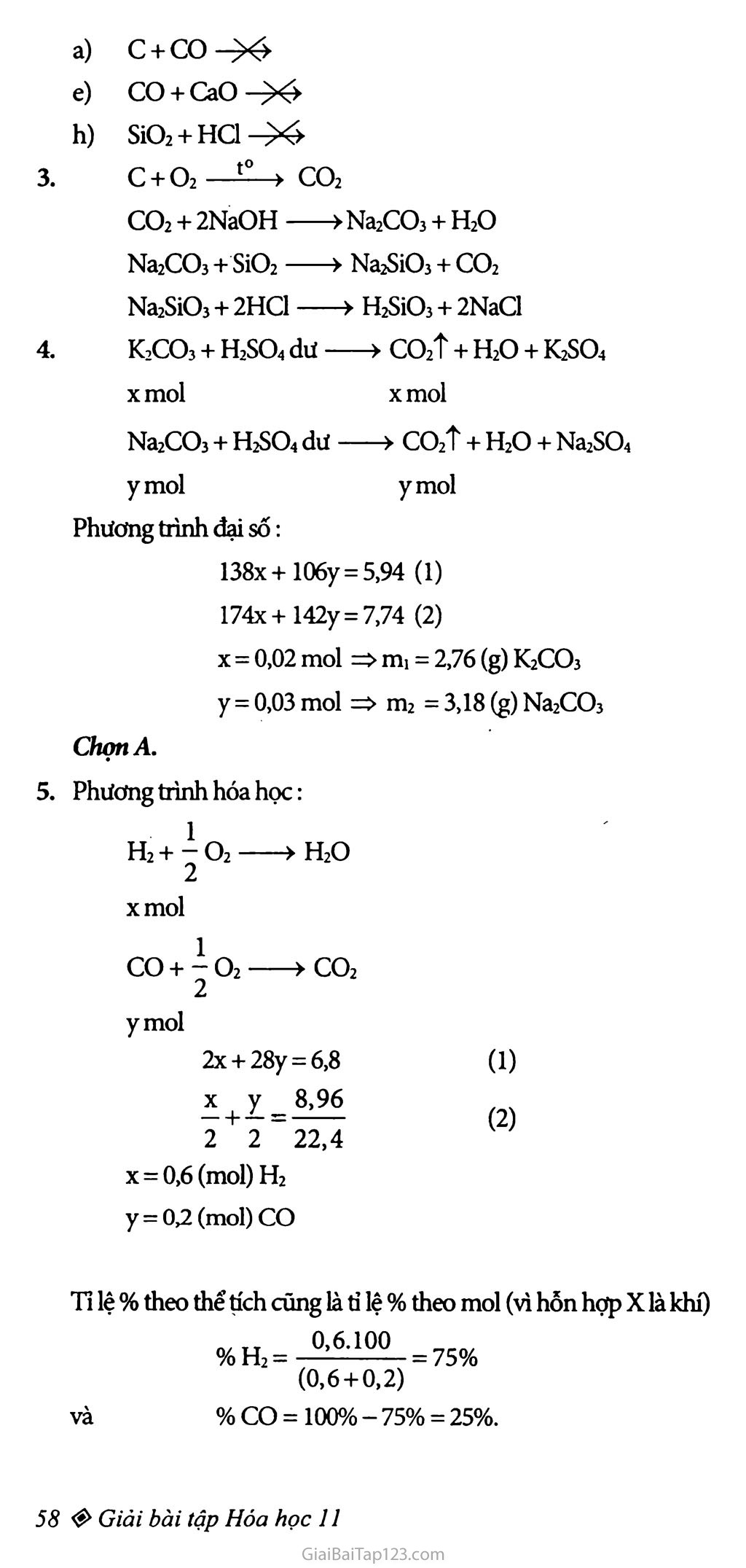
Bài 19: Luyện tập tính chất của cacbon, silic BÀI TẬP: Nêu những điểm giống nhau và khác nhau về tinh chất giữa cacbon đioxit và silic đioxit. Phàn ứng hóa học không xảy ra ở những cặp chất nào sau đây? c và CO d) H2CO3 và Na2SiO3 h) S1O2 và HCI CO2vàNaOH e) co và CaO i)SivàNaOH. K2CO3 và S1O2 g) CO2 và Mg Có các chất sau: CO2, Na2CO3, c, NaOH, Na2SiO3, H2SÌO3. Hãy lập thành một dãy chuyển hóa giữa các chất và viết các phương trinh hóa học. Cho 5,94g hỗn hợp K.2CO3 và Na2CŨ3 tác dụng với dung dịch H2SO4 dư thu được 7,74g hỗn hợp các muối khan K.2SO4 và Na2SO4. Thành phần của hỗn hợp đầu là: 3,18g Na2CO3 và 2,76g K.2CO3 3,81g Na2CO3 và 2,67g K2CO3 3,02g Na2CO3 và 2,25g K2CO3 4,27g N32CO3 và 3,82g K2CO3. Hãy chọn đáp số đủng. Để đốt cháy 6,80g hỗn hợp X gồm hiđro và cacbon monooxit cần 8,96 lít oxi (đo ờ đktc). Xác định thành phần phần trăm theo thể tích và theo khối lượng cùa hỗn hợp X. Một loại thủy tinh có thành phần hóa học được biểu diễn bằng công thức K.2O.PbO.6SiO2. Tính khối lượng K2CO3, PbCŨ3 và S1O2 cần dùng để có thể sàn xuất được 6,77 tấn thủy tinh trên. Coi hiệu suất cùa quá trình là 100%. HƯỚNG DẪN GIẢI: a) Những điềm giống nhau vể tính chất giữa cacbon đioxit và silic đioxit: Số oxi hóa của c và Si đểu bằng+4. b) Những điểm khác nhau: Ở nhiệt độ thường CO2 là chất khí còn S1O2 là chất tinh thề. CO2 tan được trong nước; S1O2 không tan trong nước CO2 không tác dụng với HF còn S1O2 có phản ứng: S1O2 + 4HF > SiF4T + 2H2O. Phản ứng hóa học không xảy ra 3. C+CO^4 CO + CaO-X> SÍO2+HC1^>4 C+O2—CO2 CO2 + 2NaOH +Na2CO3 + H2O Na2CO3 + S1O2 ■> Na2SiO3 + CO2 NajSiOj + 2HC1 — -> H2S1O3 + 2NaCl K2CO3 + H2SO4 dư ■ >CO2t + H2O + K2SO4 xmol xmol Na2CO3 + H2SO4 dư : > co2t + H2O + Na2SO4 ymol ymol Phương trình đại số: 138x+106y = 5,94 (1) 174x+142y = 7,74 (2) X = 0,02 mol => mi = 2,76 (g) K2CO3 y = 0,03 mol => m2 = 3,18 (g) Na2CO3 ChọnA. Phương trình hóa học: 1 H2+7O2 >H20 2 xmol 1 CO + O2 ► CO2 2 (1) (2) ymol 2x + 28y - 6,8 X | y _ 8,96 2 2~ 22,4 X=0,6 (mol) H2 y = 0,2 (mol) co Tỉ lệ % theo thề tích cũng là tì lệ % theo mol (vì hỗn hợp X là khí) %H2 = =75% (0,6+ 0,2) và % CO = 100% - 75% = 25%. Tỉ lệ % theo khối lượng : n/TT 1,2.100 %H2 = - ; =17,65% 6,8 và % CO = 82,35 %. Thủy tinh là một oxit kép K2O.PbO.6SiO2 nên có khối lượng mol là: M = (39 X 2) + 16 + (207 + 16) + (28 + 32)6 = 677 (g/mol) * Để sản xuất 6,77 tấn hay (6,77. lO^g) thủy tinh trên thì số mol thủy tinh cẩn có là: 6,77.106 677 = 104 moi (hay 104 mol K2O; 104 mol PbO; 6.104 mol SiO2) * Do các phương trình hóa học: K2CO3—»k2o+co2T 1 mol 1 mol PbCOj —PbO + co2t 1 mol 1 mol Suy ra: Số mol của K2CO3 là 104 hay khối lượng K2CO3 cần: = 138.104 (g) = 1380000 (g) = 1380 (kg) Tương tự số mol của Pbco3 bằng 104 hay khối lượng PbCO3 cấn: mpbcOj = 267.104 (g) = 2670000 (g) = 2670 (kg) Và số mol của SiO2 bằng 6.104 hay khối lượng SiO2 cẩn: ơTsiạ = 6.60.104 (g) = 3600000 (g) = 3600 (kg)