Giải bài tập Hóa 11 Bài 16: Hợp chất của cacbon
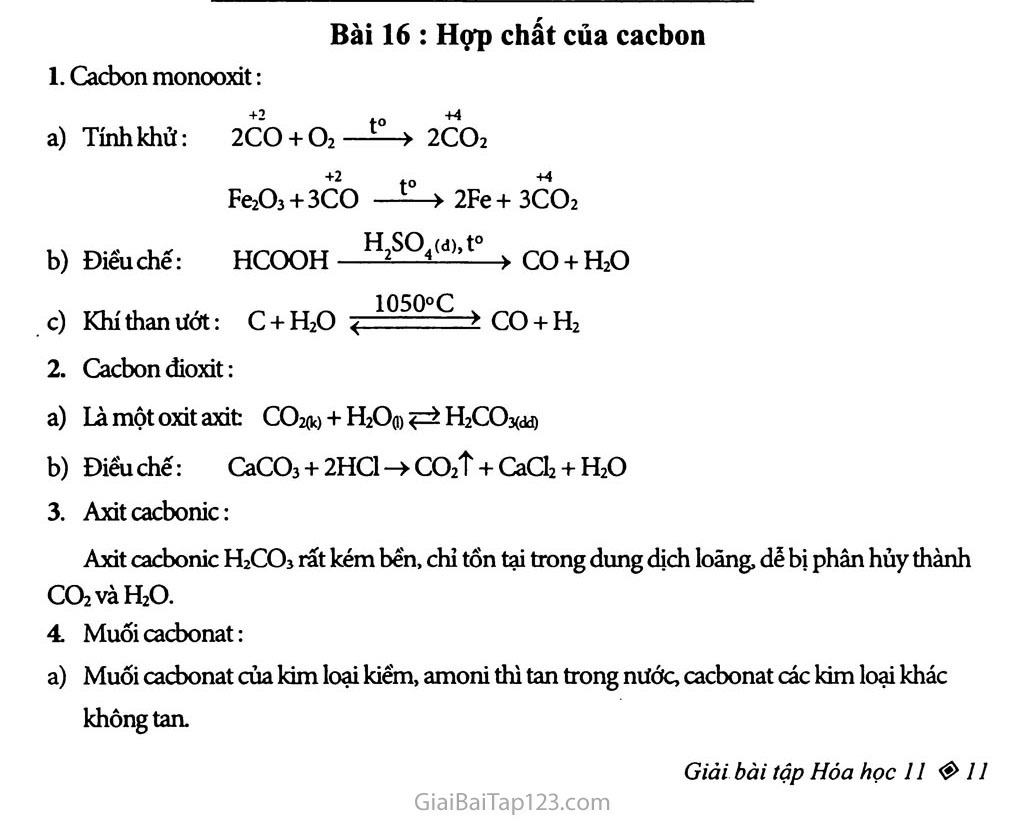
Bài 16 : Hợp chất của cacbon Cacbon monooxit: Tính khử: 2CO + O2——> 2CO2 Fe2O3 + 3CO —í—> 2Fe+ 3CO2 Điểu chế: HCOQH H^SQ CO + H2O 1050°C Khí than ướt: c + H2O < co + H2 Cacbon đioxit: Là một oxit axit co2(k) + H2O(1) LLCOxdđ) Điểu chế: CaCO3 + 2HC1 -> co2t + CaCl2 + H2O Axit cacbonic: Axit cacbonic H2CO3 rất kém bến, chỉ tổn tại trong dung dịch loãng, dễ bị phân hủy thành CO2vaH2O. Muối cacbonat: a) Muối cacbonat của kim loại kiểm, amoni thì tan trong nước, cacbonat các kim loại khác không tan. Thí dụ: Na2CO3:tan CaCƠ3: không tan Muối hiđrocacbonat HCO- thì tan trong nước. Thí dụ: Ca(HCOs)2: tan Muối cacbonat của kim loại kiềm thì bển với nhiệt Muối cacbonat của kim loại khác hay muối hiđrocacbonat bị nhiệt phân: MgCOj (r) —MgO (r) + co2t (k) 2NaHCO3(r) —Na2CO3(r) + co2t (k) + H2O (k) BÀI TẬP: Làm thế nào để loại hơi nước và khí CO2 có lẫn trong khi co? Viết các phương trình hóa học. Có ba chất khí gồm co. HC1 và SO2 đựng trong ba binh riêng biệt. Trình bày phương pháp hóa học để phân biệt từng khí. Viết các phương trình hóa học. Điều nào sau đây không đúng cho phản ứng cùa khí co với khí 02? Phản ứng thu nhiệt. Phản ứng tỏa nhiệt. c. Phàn ứng kèm theo sự giám thề tích. D. Phàn ứng không xảy ra ờ điều kiện thường. a) Khi đun nóng dung dịch canxi hiđrocacbonat thì có kết tùa xuất hiện. Tổng các hệ số tì lượng trong phương trình hóa học cùa phản ứng là: Cho 224,0 ml khí CO2 (đktc) hấp thụ hết trong 100,0 ml dung dịch kali hiđroxit 0,200M. Tinh khối lượng của những chất có trong dung dịch tạo thành. Nung 52,65 g CaCOỉ ờ 1000°C và cho toàn bộ lượng khí thoát ra hấp thụ hết vào 500,0 ml dung dịch NaOH 1,800M. Hói thu được những muối nào? Khối lượng là bao nhiêu? Biết ràng hiệu suất cùa phản ứng nhiệt phân CaCCb là 95%. ★ HƯỚNG DẪN GIẢI: Loại hơi nước và khí CO2 có lẫn frong khí co bằng cách cho hỗn hợp này qua dung dịch nước vôi trong có dư: CO2 + Ca(OH)2 > CaCO3ị + H2O Hơi nước bị hấp thụ vào dung dịch này. Trước tiên chuyển một phần khí của từng bình vào các mẫu bình chứa khác để thử. Mầu nào gặp dung dịch AgNO3 cho kết tủa trắng là HC1 HC1 + AgNO3 > AgClị + HNO3. Mẫu nào làm phai màu đỏ dung dịch brom là SO2 SO2 + Br2 + 2H2O ——> 2HBr + H2SO4. Mẫu còn lại là co. Chọn A: Phản ứng thu nhiệt là sai. Phương trình hóa học: Ca(HCO3)2 —£-> CaCO3ị + co2t + H2O Tổng số các hệ số tì lượng trong phản ứng là 4. Chọn A. Phương trình hóa học: CO2 + CaCO3 + H2O > Ca(HCO3)2 Tổng hệ số tỉ lượng trong phản ứng là 4. Chọn A. Phương trình phản ứng hóa học: CO2 + 2KOH > K2CO3 + H2O 0,01 0,02 0,01 mol So mol CO2 : ~~~ -0,01 mol 22,4 SómolKOH: 0,200.0,1 = 0,02 mol Phản ứng đúng tỉ lệ nên tạo ra K2CO3. Khối lượng K2CO3 tạo ra là: 138.0,01 = 138(g). Phương trinh phản ứng hóa học: CaCO3 —> CaO + co2t _ 52,65 SốmolCaCO3: -7 ’= 0,5265 mol 100 95 Số mol CaCO3 thực thụ dùng được: 0,5265 . 777 = 0,5 mol 100 Số mol NaOH: 1,8.03 = 0,9 mol Vì số mol co2 bằng 0,5 mol Và số mol NaOH bằng 0,9 mol TỉsốTcó: T=^~ =1,8 nco2 1<T=1,8<2 Có 2 muối: CƠ2 + NaOH > NaHCƠ3 X X xmol CO2 + 2NaOH > Na2CO3 + H2O (1) y 2y ymol Phương trinh đại số: x + y=nCOỉ = 0,5 x+2y=nNaOH = 0,9 Suyra:y = 0,4 moL Khối lượng Na2CO3: mi = 0,4.106 = 42,4 (g). Suyra:x = 0,1 mol Số gam NaHCO3 là: 0,1.84 = 8,4 (g).