Giải bài tập Hóa 11 Bài 11: Axit photphoric và muối photphat
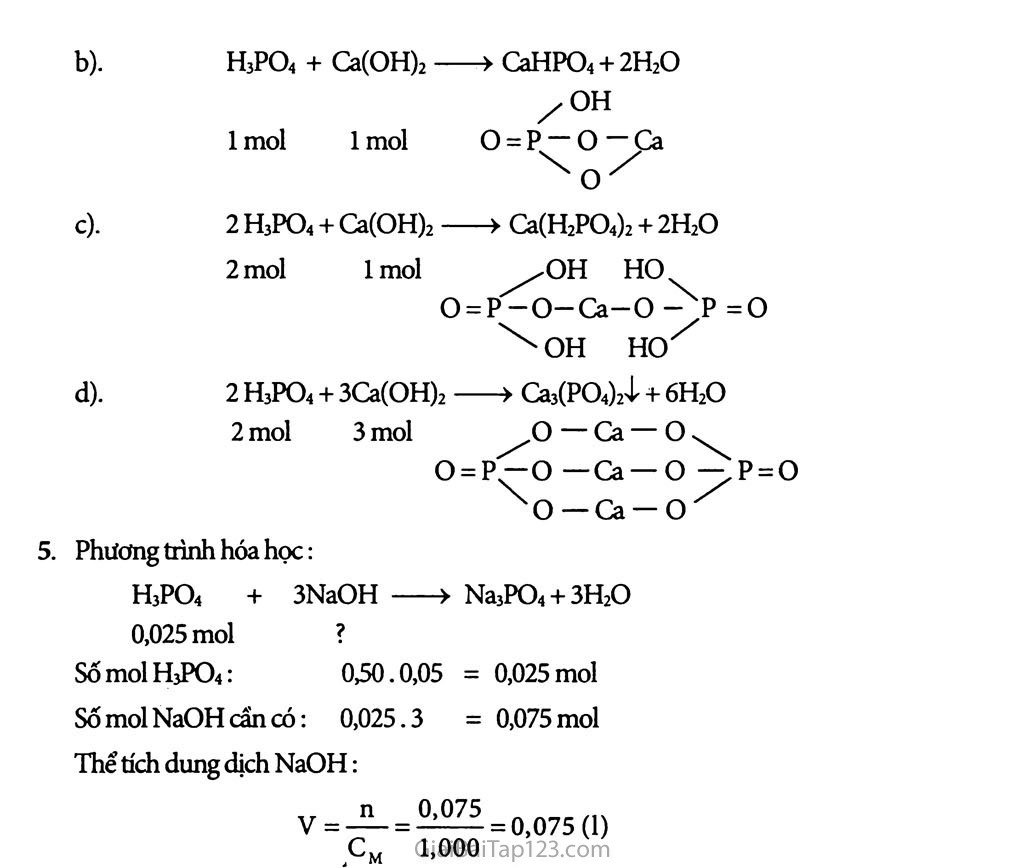
H-O—^P = O H-0 Phốt pho có số oxi hóa cao nhất bằng +5. Axit photphoric là axit có độ mạnh trung bình, là tinh thể trong suốt và nóng chảy ở 42,5°c. Axit photphoric là axit ba nấc nên có thể tạo ra 3 loại muối: Muối đihiđrophotphat H2PO~ Muốihiđrophotphat HPO2- - Muối photphat trung hòa PO’-. Nhận biết ion; PO’“ nhờ dung dịch AgNO3 3Ag+ + PO’- —> AgsPO4 ị (vàng) ★ BÀI TẬP: Viết phương trình hóa học dạng phân tứ và dạng ion rút gọn của phàn ứng giữa H3PO4 với lượng dư cùa: a) BaO b) Ca(OH)2 c) K.2CO3 Nêu những điểm giống nhau và khác nhau về tính chất hóa học giữa axit nitric và axit photphoric. Dần ra những phàn ứng hóa học để minh họa. Phương trình điện li tổng cộng của H3PO4 trong dung dịch là: H3PO4 3H+ + PO’’ Khi thêm HC1 vào dung dịch, cân bằng trên chuyển dịch theo chiều thuận. cân bang trên chuyển dịch theo chiều nghịch, c. cân bàng trên không bị chuyền dịch. D. nồng độ po) tăng lên. Lập các phương trình hóa học sau đây. H3PO4 + K2HPO4 > 1 mol 1 mol H3PO4 + Ca(OH)2 > mol 1 mol H3PO4 + Ca(OH)2 > mol 1 mol H3PO4 + Ca(OH)2 > 2 mol 3 mol Để thu được muối photphat trung hòa, cần lấy bao nhiêu ml dung dịch NaOH 1,00M cho tác dụng với 50,0 ml dung dịch H3PO4 0,50M? ★ HƯỚNG DẪN GIẢI: a) 2H3PO4 + 3BaO > Ba3(PO4)2ị + 3H2O 2H3PO4 + 3Ca(OH)2 > Ca3(PO4)2^ + 6H2O 2H3PO4 + 3Ca2+ + 6OH- > Ca3(PO4)2 + 6H2O 2H3PO4 + 3K2CO3 > 2K3PO4 + 3H2O + 3CO2 2H3PO4 + 3 cc^ > 2 POf + 3CƠ2 + 3H2O a) Những điểm giống nhau vế tính chất hóa học của axit nitric và axit photphoric: Giống nhau do các tính chất chung của một axit vô cơ (chất chỉ thị màu, phản ứng trung hòa...) b) Những điểm khác nhau về tính chất hóa học của axit nitric và axií photphoric là: Axit nitric có 1 nấc điện li, aãt photphoric có 3 nấc điện lí Axit nitric là 1 axit mạnh, axit photphoric là axit có độ mạnh trung bình. Axit nitric có tính OH hóa, còn axit photphoric không có tính oxi hóa Phương trình điện li tổng cộng: H3PO4 < -2 3H+ + PO^" Thêm HC1 vào dung dịch thi tăng số ion H+; theo nguyên lí chuyển dời mức cân bằng thì sẽ chuyền dời vê' phía HjPO4 tức là theo chiểu nghịch. Chọn B. 4 Lập các phương trình phản ứng sau a). H3PƠ4 + K2HPƠ4 > 2KH2PO4 1 mol 1 mol . H3PO4 + Ca(OH)2 > CaHPO4 + 2H2O ZOH mol 1 mol o = p — o — Ca . 2 H3PO4 + Ca(OH)2 > Ca(H2PO4)2 + 2H2O mol lmol ^/OH HO O = PjO-Ca-O =0 OH HO^ . 2 H3PO4 + 3Ca(OH)2 > Ca3(PO4)2ị + 6H2O 2 mol 3 mol ^o — Ca — o .. O = P^-O —Ca —o ^P = 0 5. xo — Ca-cr Phương trình hóa học: Na3PO4 + 3H2O = 0,025 mol = 0,075 mol H3PO4 + 3NaOH ) 0,025 mol ? SốmolH3PO4: 0,50.0,05 Số mol NaOH cấn có: 0,025.3 Thể tích dung dịch NaOH: 0,075 1,000 = 0,075 (1)