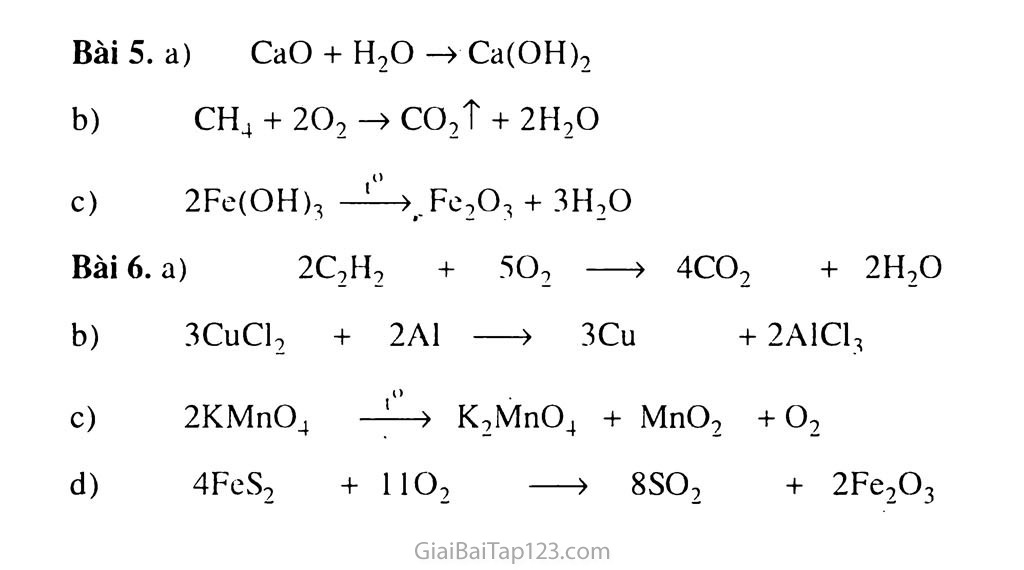Giải bài tập Hóa 8 Bài 16: Phương trình hóa học
Bài 16. PHƯƠNG TRÌNH HOÁ HỌC A. KIẾN THỨC TRỌNG TÂM Phương trình hoá học dùng để biểu diễn phản ứng hoá học gồm công thức hoá học của các chất phản ứng và sản phẩm với các hệ số thích hợp. Mỗi phương trình hoá học biểu thị một phản ứng hoá học, một hiện tượng thực tê' có thể xảy ra. Lưu ý : Phương trình hoá học - biểu thị sự biến đổi từ chất này thành chất khác, khác với phương trình toán học - biểu thị sự bằng nhau giữa hai vế. Không được hoán vị chất đầu (chất phản ứng) và chất cuối (sản phẩm) của phương trình hoá học, như hai vế của phương trình toán học. Phương trình hoá học biểu diễn phản ứng hoá học và cho biết : Chất tham gia và sản phẩm tạo thành sau phản ứng ; Phản ứng xảy ra trong điều kiện nào ? Tỉ lệ giữa các chất tham gia và sản phẩm tạo thành về : + Số nguyên tử (phân tử) ; + Khối lượng ; + Số mol. Các bước lập phương trìrih hoá học Bước l : Viết sơ đồ phản ứng : Vế trái viết công thức hoá học của các chất tham gia phản ứng rồi để mũi tên theo chiều từ trái sang phải, vế phải viết công thức hoá học của các chất sản phẩm phản ứng. Điều lưu ý là tất cả các công thức hoá học đều phải viết đúng ở bước này. Bước 2 : Đếm và cân bằng số nguyên tử của mỗi nguyên tố trong các sản phẩm và chất tham gia phản ứng. Nếu trong công thức của chất có nhóm nguyên tử như nhóm -OH hoặc nhóm = so4, nhóm -NO3,... thì coi các nhóm đó như .một đơn vị để cân bằng. Trong bước này ta tìm hệ số của các chất đó là các số nguyên nhỏ nhất đật trước công thức của chất thích hợp để phản ánh định luật bảo toàn khối lượng : Tổng sô' nguyên tử của từng nguyền tố tạo nên các chất tham gia phản ứng bằng tổng số các nguyên tử của các nguyên tô đó trong các sản phẩm của phán ứng. • Bước 3 : Viết phương trình hoá học (PTHH) đã cân bằng và kiểm tra lại các hệ số đã viết. B. HƯỚNG DẪN GIẢI BÀI TẬP TRONG SGK Bài 1. b) Sơ đồ của phán ứng khác với phương trình hoá học là chưa có hệ số thích hợp, tức là chưa càn bằng số nguyên tử. (có một số trường hợp thì sơ đồ cũng là phương trình hoá học, thí dụ : c + O2 —» COọ) Bài 2. a) 4Na + O2 —> 2Na2O Số nguyên tự Na : số phân tú Oọ : số phân tử Naọo = 4 : 1:2. b) P2O5 + 3H2O -» 2H3PO4 Số phán tử P2O5 : số phân tử HọO : số phân tử H3PO4 =1:3:2. Bài 3. a) 2HgO -> 2Hg + 02 Số phân tử HgO : số nguyên tứ Hg : số phân tử 02 = 2 : 2 : 1 b) 2Fe(OH)3 —> Fe2O3 + 3H2O Số phân tử Fe(OH)3 : số phân tử Fe2O3 : số phân tử HọO = 2:1:3. Bài 4. a) Na2CO3 + CaCl2 -> CaCO3 + 2NaCl Bài 5. a) Phương trình hoá học cứa phản ứng (cũng là sơ đồ) : Mg + H2SO4 —> MgSO4 + H2 b) Đều là tỉ lệ 1 : 1. Bài 6. a) Phương trình hoá học của phản ứng : 4P + 5O2 —> 2P2O5 b) Số nguyên tử p : số phân tử Oọ : số phân tử P2O5 = 4:5:2 Bài 7. a) 2Cu + 02 —> 2CuO Zn + 2HC1 -> ZnCl2 + H2 CaO + 2HNO3 -> Ca(NO3)2 + H2O c. BÀI TẬP Bổ SUNG VÀ HƯỚNG DAN GIẦI BÀI TẬP Bài 1. Nêu các bước lập PTHH của các trường hợp sau : Hiđro (H2) phán ứng với oxi (O2) tạo thành nước (H2O). Đốt cháy lượng nhỏ bột sắt (Fe) trong oxi (O2) thu được sắt(III) oxit (Fe2O3). Hoà tan vôi sống (CaO) vào nước (H2O) thu được vôi tôi (Ca(OH)2). Bài 2. Sơ đồ sau mô phóng phán ứng tạo ra khí cacbonic : S 8 •d • o o °, o ® Nguyên tư cacbon o Nguyên tử oxi Hãy viết phương trình hoá học cho phản ứng trên. Bài 3. Hãy ghép một trong các chữ a. b, c, d. e (chỉ sản phẩm phản ứng) với mỗi chữ số 1, 2, 3 (chỉ chất tham gia phản ứng) để tạo thành một phương trình hoá học đúng. 1 2A1 + 6HC1 -> a A1C13+ 3H2 T ■ 2 2Fe(OH)3-> b 2P2O5 3 4P * 5 o2 -> c 2FeO+ 3H2O d Fe,O3 + 3HỌO e 2A1C1-, + 3H2 T f P2O5 Bài 4. Lập phương trình hoá học của sơ đồ phản ứng sau rồi điền vào ô trống trong bảng những thông tin cần thiết: Sơ đồ phản ứng Chất tham gia. tỉ lệ số phân tữ Chất tạo thành, tỉ lệ số phân tử Zn + H2SO4 > ZnSO4 + H2 A12O3 + hci-4 aici3 +h20 AI + ©2 > AI2O3 CaO + co2 > CaCO3 Bài 5. Viết và cân bằng các phương trình hoá học biểu diễn các quá trình hoá học sau đây : Cho canxi oxit tác dụng với nước, thu được canxi hiđroxit: Ca(OH)2. Đốt cháy khí metan : CH4 thu được cacbon(IV) oxit và hơi nước ; Nung sắt(III) hiđroxit (Fe(OH)3) ở nhiệt độ cao thu được Fe(III) oxit và hơi nước. Bài 6. Lập phương trình hoá học của phản ứng cho các trường hợp sau : Đốt cháy khí axetilen thu được khí cacbonic và nước CuCl2 + AI > Cu + A1C13 Nung nóng KMnO4 thu được K0MnO4, MnO2 và khí oxi. FeS2 + 02 > so2 + Fe2O3 II. HƯỚNG DẪN GIẢI Bài 1. a) Bước 1 : H2 + 02 > H2O Bước 2 : H2 + 02 > 2H2O Bước 3 : 2H2 + 02 —» 2H2O Kiểm tra lại : 4H + 20 = 4H + 20 Bước 1 và bước 2 : Fe + 02 > Fe,O3 2Fe + O2 » Fe2O3 Trong vế trái đế có hệ số của ọ2 là số nguyên, cần nhân 2 với 3 (cứa o ớ vế phải) đê tìm được hệ số của 02 trong vê' trái là 3. Bước 3 : 4Fe + 3O2 -» 2Fe2O3 Kiểm tra lại : 4Fe •+ 60 —> 4Fe + 60 Bước 1 và bước 2 : CaO + H20 > Ca(0H)2 Bước 3 : CaO + H20 -> Ca(OH)2 Kiểm tra lại : ICa + 2H + 20 = ICa + 2H + 20 Bài 2. 2C0 + 02 —-> 2CO2 Bài 3. Đổ có một phương trình hoá học đúng thì phương trình đó phải phản ánh được định luật bảo toàn số nguyên tử tạo nên các chất. 1 - e ; 2 - d ; 3 - b. Bài 4. Phương trình hoá học Chất tham gia, ti lệ sô' phân tử Chất tạo thành, tỉ lệ sô' phân tử Zn + H2SO4 -> ZnSO4 + H2 nZn ■ nH2SO4 = 1 : 1 nZnSO4 : nH, =1:1 A12O3 + 6HCl-> 2A1C13 + 3H2O nAi2o3 : nHCi =1:6 nAici3 : nH2o =2 :’3 4A1 + 30, > 2A1,O3 nAi : no2 = 4 : 3 A12O3 CaO + co, > CaCO3 nCaù ■ nco2 = 1:1 CaC03 Bài 5. a) CaO + H,o —> Ca(OH), CH4 + 20, -> CO,T + 2H,0 2Fe(OH)3 -^t.Fe2O3 + 3H,O Bài 6. a) 2C,H, + 50, > 4CO2 + 2H,0 3CuCl, + 2A1 > 3Cu + 2A1C1, 2KMnO_ị ——> K2MnO4 + MnO, + o, 4FeS, + 110, > 8SO, + 2Fe2O3