SGK Hóa Học 10 - Bài 21. Khái quát về nhóm halogen
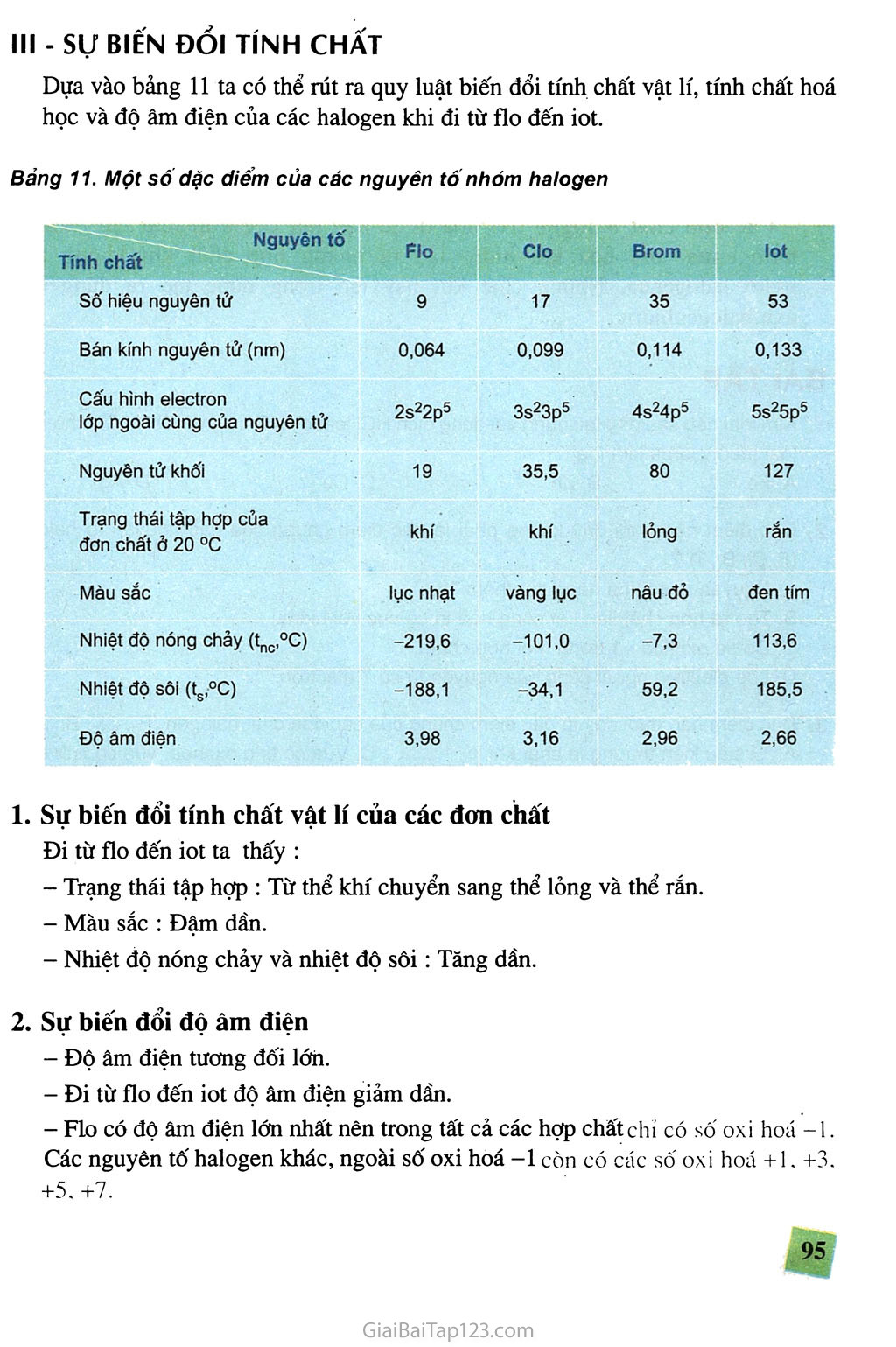
Chương lx.-k.j-. MM ✓ Nhóm halogen gồm những nguyên tố nào ? Có tính chất hoá học cơ bản gì ? Nguyên nhân nào làm cho các halogen có sự giống nhau về tính chất cũng như sự biến đồi có quy luật tính chất của đơn chất và họp chất của chúng ? ✓ Những họp chất nào của halogen có nhiều ứng dụng trong thực tiễn ? Bằng Cách nào có thể điều chế được các halogen và các hợp chất quan trọng của chúng ? Nhà máy hoá chất Biên Hoà, tỉnh Đồng Nai (Công ti Hoá chất cơ bản miền Nam) . KHÁI QUÁT VÊ NHÓM HALOGEN Nhóm halogen gồm những nguyên tố nào và chúng ớ vị trí nào trong bảng tuần hoàn ? Lớp electron ngoài cùng cúa nguyên tứ các nguyên tố halogen có đặc điểm gì giống nhau ? Các phân tử halogen có cấu tạo như thế nào ? Tính chất hoá học cơ bản của các nguyên tố halogen là gì ? Nguyên nhân nào làm cho tính chất hoá học của các nguyên tố halogen biến đối có quy luật ? - VỊ TRÍ CỦA NHÓM HALOGEN TRONG BẢNG TUẦN HOÀN Nhóm halogen gồm các nguyên tố flo (F), clo (Cl), brom (Br), iot (I) và atatin (At). Atatin không gặp trong tự nhiên, nó được .điều chế nhân tạo trong các lò phản ứng hạt nhân nên được xem xét chủ yếu trong nhóm các nguyên tố phóng xạ. Những nguyên tố halogen thuộc nhóm VIIA. Chúng đứng ở cuối các chu kì, ngay trước các nguyên tố khí hiếm. - CẤU HÌNH ELECTRON NGUYÊN TỬ, CẤU TẠO PHẢN TỬ Lớp electron ngoài cùng của nguyên tử các nguyên tố halogen đều có 7 electron, được phân thành 2 phân lớp : phân lớp s có 2 electron, phân lớp p có 5 electron (ns2np5). Do có 7 electron ở lớp ngoài cùng, chỉ còn thiếu 1 electron là đạt được cấu hình electron bền như khí hiếm, nên ở trạng thái tự do, hai nguyên tử halogen góp chung một đôi electron để tạo ra phân tử có liên kết cộng hoá trị không cực. :X. + "X: > :X: X: , hay X-X hoặc x2 (X là kí hiệu chỉ các nguyên tố halogen). Liên kết của phân tử X2 không bền lắm, chúng dễ bị tách thành 2 nguyên tử X. Trong phản ứng hoá học, các nguyên tử này rất hoạt động vì chúng dễ thu thêm 1 electron, do đó tính chất hoá học cơ bản của các halogen là tính oxi hoá mạnh. Ill - sự BIÊN ĐỔI TÍNH CHẤT Dựa vào bảng 11 ta có thể rút ra quy luật biến đổi tính chất vật lí, tính chất hoá học và độ âm điện của các halogen khi đi từ flo đến iot. Bảng 11. Một sô đặc điểm của các nguyên tó nhóm halogen Nguyên tố Tính chất Flo Clo Brom lot Sô' hiệu nguyên tử 9 17 35 53 Bán kính nguyên tử (nm) 0,064 0,099 0,114 0,133 Cấu hình electron lớp ngoài cùng của nguyên tử 2s22p5 3s23p5 4s24p5 5s25p5 Nguyên tử khối 19 35,5 80 127 Trạng thái tập hợp của đơn chất ở 20 °C khí khí lỏng rắn Màu sắc lục nhạt vàng lục nâu đỏ đen tím Nhiệt độ nóng chảy (tnc,°C) -219,6 -101,0 -7,3 113,6 Nhiệt độ sôi (ts,°C) -188,1 -34,1 59,2 185,5 Độ âm điện 3,98 3,16 2,96 2,66 Sự biến đổi tính chất vật lí của các đơn chất Đi từ flo đến iot ta thấy : Trạng thái tập họp : Từ thể khí chuyển sang thể lỏng và thể rắn. Màu sắc : Đậm dần. Nhiệt độ nóng chảy và nhiệt độ sôi: Tăng dần. Sự biến đổi độ âm điện Độ âm điện tương đối lớn. Đi từ flo đến iot độ âm điện giảm dần. Flo có độ âm điện lớn nhất nên trong tất cả các hợp chất chỉ có số oxi hoá -1. Các nguyên tố halogen khác, ngoài số oxi hoá -1 còn có các số oxi hoá +1, +3, +5,+7. Sự biến đói tính chất hoá học của các đơn chất Vì lớp electron ngoài cùng có cấu tạo tương tự nhau (ns2np5) nên các đơn chất halogen giống nhau về tính chất hoá học cũng như thành phần và tính chất của các hợp chất do chúng tạo thành. Halogen là những phi kim điển hình. Đi từ flo đến iot, tính oxi hoá giảm dần. Các đơn chất halogen oxi hoá được hầu hết các kim loại tạo ra muối halogenua, oxi hoá khí hiđro tạo ra những hợp chất khí không màu hiđro halogenua. Những chất khí này tan trong nước tạo ra dung dịch axit halogenhiđric. BÀI TẬP Kim loại nào sau đây tác dụng với dung dịch HCI loãng và tác dụng với khí Cl2 cho cùng loại muối clorua kim loại ? A. Fe. B. Zn. c. Cu. D. Ag. Đặc điểm nào dưới đây không phải là đặc điểm chung của các nguyên tô' halogen (F, Cl, Br, I) ? Nguyên tử có khả năng thu thêm 1e. Tạo ra hợp chất liên kết cộng hoá trị có cực với hiđro. c. Có số oxi hoá -1 trong mọi hợp chất. D. Lớp electron ngoài cùng của nguyên tử có 7 electron. Đặc điểm nào dưới đây là đặc điểm chung của các đơn chất halogen (F2, Cl2, Br2, I2): Ở điều kiện thường là chất khí. c. Vừa có tính oxi hoá, vừa có tính khử. Có tính oxi hoá mạnh. D. Tác dụng mạnh với nước. So sánh những nguyên tố halogen về các mặt sau : Cấu tạo nguyên tử và cấu tạo phân tử. Tính chất vật lí. Tính chất hoá học. Hãy cho biết tính quy luật sự biến đổi của nhiệt độ nóng ctìảy, nhiệt độ sôi, màu sắc, độ âm điện của các nguyên tố halogen. Nêu tính chất hoá học cơ bản của các nguyên tố halogen và giải thích chiểu biến đổi tính chất hoá học cơ bản đó. Giải thích vì sao các nguyên tô' halogen không có ở trạng thái tự do trong tự nhiên. Cho một lượng đơn chất halogen tác dụng hết với magie thu được 19 g magie halogenua. Cũng lượng đơn chất halogen đó tác dụng hết với nhôm tạo ra 17,8 g nhôm halogenua. Xác định tên và khối lượng đơn chất halogen nói trên.