SGK Hóa Học 10 - Bài 22. Clo
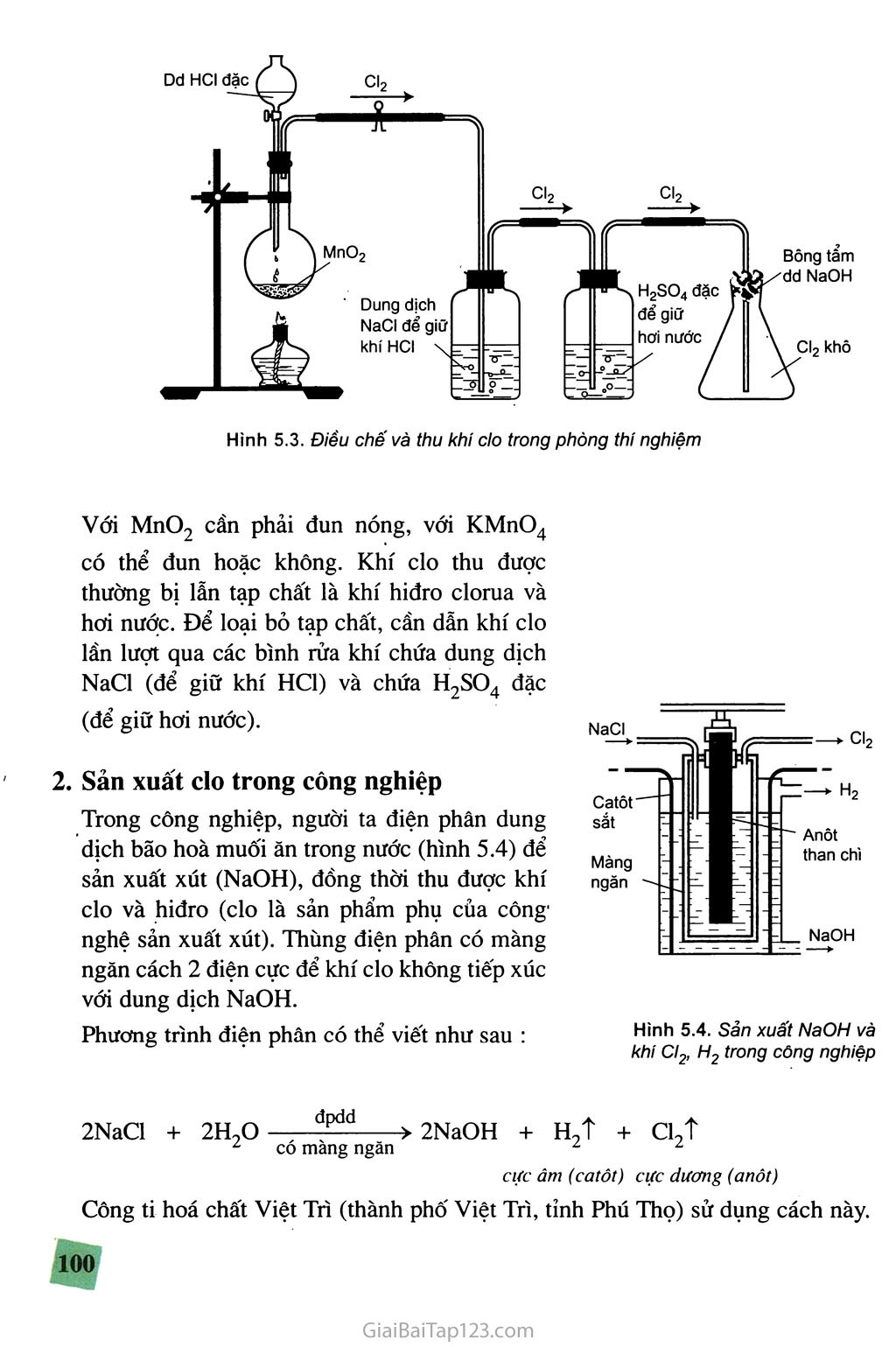
I Bài CLO clo là nguyên tố halogen tiêu biếu và quan trọng nhất. Vậy clo có tính chất vật lí và tính chất hoá học gì ? Clo có những ứng dụng gì và điều chế bằng cách nào ? - TÍNH CHẤT VẬT LÍ Ở điều kiện thường, clo là khí màu vàng lục, mùi xốc, rất độc, nó phá hoại niêm mạc của đường hô hấp. Khí clo nặng gấp 2,5 lần không khí và tan trong nước. Ở 20 °C, một thể tích nước hoà tan 2,5 thể tích khí clo. Dung dịch của khí clo trong nước còn gọi là nước clo có màu vàng nhạt. Khí clo tan nhiều trong các dung môi hữu cơ như benzen, etanol, hexan, cacbon tetraclorua... - TÍNH CHẤT HOÁ HỌC Nguyên tử clo có độ âm điện lớn (3,16), chỉ đứng sau nguyên tử flo (3,98) và nguyên tử oxi (3,44). Vì vậy, trong hợp chất với các nguyên tố này, clo có số oxi hoá dương (+1, +3, +5, +7), còn trong các trường hợp khác, clo có số oxi hoá âm (-1). Khi tham gia phản ứng, nguyên tử clo dễ nhận thêm le để thành ion clorua C1 . Vì vậy, tính chất hoá học cơ bản của clo là tính oxi hoá mạnh. Tính chất này được thể hiện qua các phản ứng sau : Tác dụng với kim loại Khí clo oxi hoá trực tiếp được hầu hết các kim loại tạo ra muối clorua, phản ứng xảy ra ở nhiệt độ thường hoặc không cao lắm, tốc độ nhanh, toả nhiều nhiệt. Natri nóng chảy cháy trong khí clo với ngọn lửa sáng chói, tạo ra natri clorua : 0 0 2Na + Cl2 + 1 -1 2NaCl 97 •HOÀHỌC 10-A Hình 5.1. Đồng cháy trong khí clo Dây đồng nung đỏ cháy trong khí clo tạo thành đồng(II) clorua : Hình 5.2. Sắt cháy trong khí cto Dây sắt nung đỏ cháy trong khí clo tạo thành khói màu nâu là những hạt sắt(III) clorua : 0 0 +2 -1 Cu + Cl2 —> CuCl2 0 0 +3-1 2Fe + 3C12 —> 2FeCl3 Tác dụng với hiđro Ở nhiệt độ thường và trong bóng tối, khí clo hầu như không phản ứng với khí hiđro. Khi chiếu sáng hỗn hợp bởi ánh sáng mặt trời hoặc ánh sáng của magie cháy, .phản ứng trên xảy ra nhanh và có thể nổ. Hỗn hợp nổ mạnh nhất khi tỉ lệ mol giữa hiđro và clo là 1 : 1. 0 0+1-1 H2 + Cl2 —> 2HC1 Như vậy, trong các phản ứng với kim loại và với hiđro, clo thể hiện tính bxi hoá mạnh. Tác dụng với nước Khi tan trong nước, một phần khí clo tác dụng với nước tạo ra hỗn hợp axit clohiđric và axit hipoclorơ. 0 -1 +1 Cl2 + H2O Ẹ=2 HC1 + HC1O Trong phản ứng trên, clo vừa là chất khử vừa là chất oxi hoá vì một nguyên tử C1 +1 ' -1 bị oxi hoá thành C1, một nguyên tử C1 bị khử thành C1. Phản ứng ứên là phản ứng thuận nghịch do HC1O là chất oxi hoá rất mạnh, có thể oxi hoá HC1 thành Cl2 và HọO. Cũng do HC1O là chất oxi hoá mạnh nên nước clo có tính tẩy màu. 7-HOÁHỌC 10-B - TRẠNG THÁI Tự NHIÊN Trong tự nhiên, clo có hai đồng vị bền là 35C1 (75,77%) và 37C1 (24,23%), nguyên tử khối trung bình là 35,5. Do hoạt động hoá học mạnh nên nguyên tố clo chỉ tồn tại trong tự nhiên ở dạng hợp chất, chủ yếu là muối natri clorua có trong nước biển và muối mỏ. Một lít nước biển chứa khoảng 30 g muối natri clorua. Hợp chất khác của clo cũng phổ biến trong tự nhiên như chất khoáng cacnalit KCl.MgCl2.6H9O. Axit clohiđric cũng có trong dịch vị dạ dày của người và động vật. Trong nước biển, clo chiếm khoảng 2% khối lượng. - ỨNG DỤNG Clo được dùng để diệt trùng nước sinh hoạt. Hoà tan vào nước một lượng nhỏ clo để diệt các loại vi khuẩn gây bệnh. Nước bể bơi có thể được xử lí bằng lượng khí clo nhiều hơn. Clo cũng được dùng để tẩy trắng sợi, vải, giấy. Một lượng lớn clo được dùng để sản xuất các hoá chất hữu cơ. Những sản phẩm hữu cơ chứa clo có ý nghĩa to lớn. Những dung môi như cacbon tetraclorua, đicloetan được dùng rộng rãi để chiết chất béo, khử dầu mỡ trên kim loại. Một số chất hữu cơ chứa clo được dùng làm thuốc diệt côn trùng. Từ những sản phẩm hữu cơ chứa clo người ta sản xuất được nhiều loại chất dẻo như nhựa PVC - poli(vinyỉ clorua), cao su tổng hợp, sợi tổng hợp ... Clo được dùng để sản xuất các chất tẩy trắng, sát trùng như nước Gia-ven, clorua vồi và sản xuất các hoá chất vô cơ như axit clohiđric, kali clorat... - ĐIỀU CHÊ Điều chê khí clo trong phòng thí nghiệm Trong phòng thí nghiệm, khí clo được điều chế bằng cách cho axit clohiđric đặc tác dụng với chất oxi hoá mạnh như mangan đioxit rắn (MnOọ) hoặc kali pemanganat rắn (KMnO4)... MnO2 + 4HC1 MnCl2 + cự + 2H2O 2KMnO4 + 16HC1 > 2MnCl2 + 2KC1 + 5C12T + 8H2O Với MnOọ cần phải đun nóng, với KMnO4 có thể đun hoặc không. Khí clo thu được thường bị lẫn tạp chất là khí hiđro clorua và hơi nước. Để loại bỏ tạp chất, cần dẫn khí clo lần lượt qua các bình rửa khí chứa dung dịch NaCl (để giữ khí HC1) và chứa H2SO4 đặc (để giữ hơi nước). Sản xuất clo trong công nghiệp Trong công nghiệp, người ta điện phân dung dịch bão hoà muối ăn trong nước (hình 5.4) để sản xuất xút (NaOH), đồng thời thu được khí clo và hiđro (clo là sản phẩm phụ của công' nghệ sản xuất xút). Thùng điện phân có màng ngăn cách 2 điện cực để khí clo không tiếp xúc với dung dịch NaOH. Phương trình điện phân có thể viết như sau : Hình 5.4. Sản xuất NaOH và khi Cl2, H2 trong công nghiệp 2NaCl + 2H?Q , đptl(1 > 2NaOH + H2T + cự z có màng ngăn z x cực âm (catôt) cực dương (anôt) Công ti hoá chất Việt Trì (thành phố Việt Trì, tỉnh Phú Thọ) sử dụng cách này. BÀI TẬP Trong phòng thí nghiệm, khí clo thường được điều chế bằng cách oxi hoá hợp chất nào sau đây ? NaCI. HCI. c. KCIO3. D. KMnO4. Cho biết tính chất hoá học cơ bản của nguyên tố clo. Giải thích vì sao nguyên tố clo có tính chất hoá học cơ bản đó. Cho thí dụ minh hoạ. Dan khí clo vào nước, xảy ra hiện tượng vật lí hay hoá học ? Giải thích. Nêu những ứng dụng thực tế của khí clo. Cân bằng phương trình hoá học của các phản ứng oxi hoá - khử sau bằng phương pháp thăng bằng electron : HCI - -> KCI + MnCI2 + Cl2 HCI - NO + Cl2 + H2O HCI - —> Cl2 + H2O HCI - —> PbCI2 + Cl2 + h20 + H2O 6. Tại sao trong công nghiệp người ta dùng phương pháp điện phân dung dịch NaCI bão hoà chứ không dùng sự tương tác giữa các hoá chất trong phản ứng oxi hoá - khử để sản xuất khí clo ? Cần bao nhiêu gam KMnO4 và bao nhiêu mililít dung dịch axit clohiđric 1M để điều chế đủ khí clo tác dụng với sắt, tạo nên 16,25 g FeCI3 ?