SGK Hóa Học 10 - Bài 8. Sự biến đổi tuần hoàn cấu hình electron nguyên tử của các nguyên tố hóa học
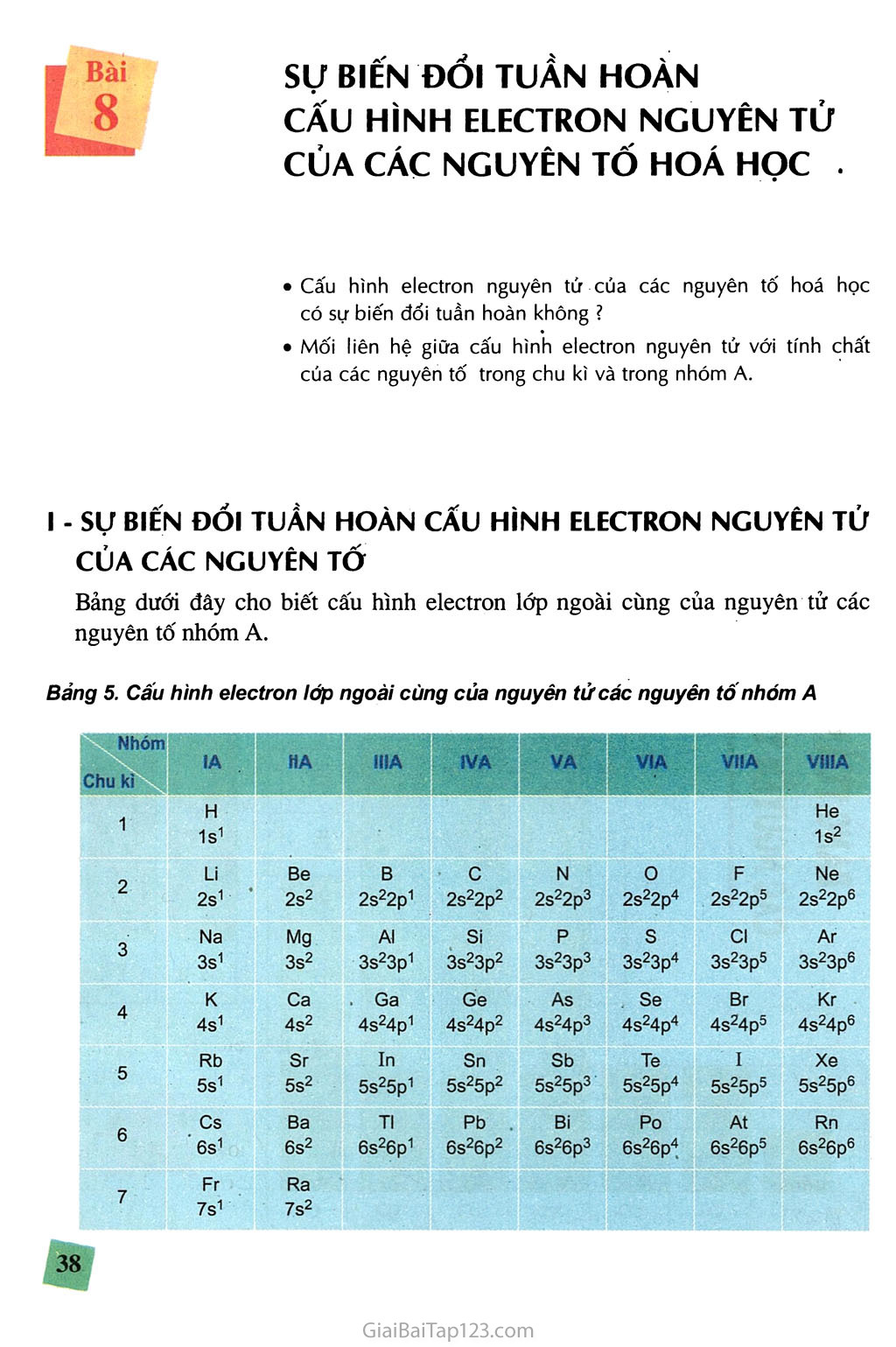
sự BIẾN ĐỔI TUẦN HOÀN CẤU HÌNH ELECTRON NGUYÊN TỬ CỦA CÁC NGUYÊN TỔ HOÁ HỌC . cấu hình electron nguyên tứ cúa các nguyên tố hoá học có sự biến đổi tuần hoàn không ? Mối liên hệ giữa cấu hình electron nguyên tử với tính chất cúa các nguyên tố trong chu kì và trong nhóm A. - SỰ BIÊN ĐÓI TUẦN HOÀN CẤU HÌNH ELECTRON NGUYÊN TỬ CỦA CÁC NGUYÊN TỐ Bảng dưới đây cho biết cấu hình electron lớp ngoài cùng của nguyên tử các nguyên tố nhóm A. Bảng 5. cấu hình electron lớp ngoài cùng của nguyên tử các nguyên tô nhóm A Nhóm Chu ki IA HA IIIA IVA VA VIA VIIA VÍIIA 1 H 1s1 He 1s2 2 Li 2s1 ■ Be 2s2 B 2s22p1 c 2s22p2 N 2s22p3 0 2s22p4 F 2s22p5 Ne 2s22p6 3 Na 3s1 Mg 3s2 AI 3s23p1 Si 3s23p2 p 3s23p3 s 3s23p4 Cl 3s23p5 Ar 3s23p6 4 K 4s1 Ca 4s2 . Ga 4s24p1 Ge 4s24p2 As 4s24p3 Se 4s24p4 Br 4sz4p5 Kr 4s24p6 5 Rb b 5s1 Sr 5s2 In 5s25p1 Sn 5s25p2 Sb 5s25p3 Te 5s25p4 I 5s25p5 Xe 5s25p6 R Cs 6 6s1 Ba 6s2 TI 6s26p1 Pb . 6s26p2 Bi 6s26p3 Po 6s26p4 At 6s26p5 Rn 6s26p6 7 Fr 7s1 Ra 7s2 Xét cấu hình electron nguyên tử của các nguyên tố trong bảng 5 tá thấy : Đầu mỗi chu kì là nguyên tố có cấu hình electron lóp ngoài cùng của nguyên tử là ns1. Kết thúc mỗi chu kì là nguyên tố có cấu hình electron lớp ngoài cùng của nguyên tử là ns2np6 (trừ chu kì 1). Cấu hình electron lớp ngoài cùng của nguyên tử các nguyên tố trong cùng một nhóm A được lặp đi lập lại sau mỗi chu kì, ta nói rằng : Chúng biến đổi một cách tuần hoàn. Như thế, sự biến đổi tuần hoàn về cấu hình electron lớp ngoài cùng của nguyên tử các nguyên tố khi điện tích hạt nhân tăng dần chính là nguyên nhân của sự biến đổi tuần hoàn tính chất của các nguyên tố. - CẤU HÌNH ELECTRON NGUYÊN TỬ CỦA CÁC NGUYÊN TÓ NHÓM A Cấu hình electron lớp ngoài cùng của nguyên tử các nguyêri tô nhóm A Nguyên tử các nguyên tố trong cùng một nhóm A có cùng số electron lớp ngoài cùng. Chính sự giống nhau về cấu hình electron lớp ngoài c.ùng của nguyên tử là nguyên nhân của sự giống nhau về tính chất hoá học của các nguyên tố trong cùng một nhóm A. Số thứ tự của nhóm (IA, IIA...) cho biết số electron ở lớp ngoài cùng và đồng thời cũng là số electron hoá trị trong nguyên tử của các nguyên tố đó. Các electron hoá trị của các nguyên tố thuộc hai nhóm IA, IIA là electron s, các nguyên tố đó là các nguyên tố s. Các electron hoá trị của các nguyên tố thuộc sáu nhóm A tiếp theo là các electron s và p, các nguyên tố đó là các nguyên tố p (trừ He). Một sô nhóm A tiêu biểu Nhóm VIIIA là nhóm khí hiếm, gồm các nguyên tố : heli, neon, agon, kripton, xenon và radon. Nguyên tử của các nguyên tố trong nhóm (trừ heli) đều có 8 electron ở lớp ngoài cùng (cấu hình electron lóp ngoài cùng là ns2np6). Đó là cấu hình electron bền vững. Hầu hết các khí hiếm đều không tham gia các phản ứng hoá học (trừ một số trường họp đặc biệt). Ó điều kiện thường, các khí hiếm đều ở trạng thái khí và phân tử chỉ gồm một nguyên tử. Nhóm IA là nhóm kim loại kiềm gồm các nguyên tố : liti, natri, kali, rubiđi, xesi (ngoài ra còn có nguyên tố phóng xạ franxi). Nguyên tử của các nguyên tố kim loại kiềm chỉ có 1 electron ở lớp ngoài cùng (cấu hình electron lớp ngoài cùng là ns1). Vì vậy, trong các phản ứng hoá học, nguyên tử của các nguyên tố kim loại kiềm có khuynh hướng nhường đi 1 electron để đạt đến cấu hình electron bền vững của khí hiếm. Do đó, trong các hợp chất, các nguyên tố kim loại kiềm chỉ có hoá trị 1. Các kim loại kiềm là những kim loại điển hình, thường có nhũng phản ứng sau : Tác dụng mạnh với oxi tạo thành các oxit bazơ tan trong nước, thí dụ LiọO, Naọo,... Tác dụng mạnh với nước ở nhiệt độ thường tạo thành hiđro và hiđroxit kiềm mạnh, thí dụ NaOH, KOH,... Tác dụng với các phi kim khác tạo thành muối, thí dụ NaCl, K2S,... Nhóm VÌIA là nhóm halogén, gồm các nguyên tố : flo, clo, brom, iot (ngoài ra còn có nguyên tố phóng xạ atatin). Nguyên tử của các nguyên tố halogen có 7 electron ở lớp ngoài cùng (cấu hình electron lớp ngoài cùng là ns2np5). Vì vậy, trong các phản ứng hoá học, các nguyền tử halogen có khuynh hướng thu thêm 1 electron để đạt đến cấu hình electron bền vững của khí hiếm. Do đó, trong các hợp chất với nguyên tố kim loại, các nguyên tố halogen có hoá trị 1. ở dạng đơn chất, các phân tử halogen gồm hai nguyên tử : F2, C1-), Br2, I2. Đó là những phi kim điển hình, thường có những phản ứng sau : Tác dụng với kim loại cho các muối như KBr, A1C13,... Tác dụng với hiđro tạo ra những hợp chất khí HF, HC1, HBr, HI ; Trong dung dịch nước chúng là những axit. Hiđroxit của các halogen là những axit, thí dụ : HC10, HClOy BÃI TẬP Các nguyên tố thuộc cùng một nhóm A có tính chất hoá học tương tự nhau, vì vỏ nguyên tử của các nguyên tô' nhóm A có số electron như nhau. số lớp electron như nhau. c. số electron thuộc lớp ngoài cùng như nhau. D. cùng số electron s hay p. Chọn đáp án đúng. Sự biến thiên tính chất của các nguyên tô' thuộc chu kì sau được lặp lại tương tự như chu kì trước là do : Sự lặp lại tính chất kim loại của các nguyên tô' ở chu kì sau so với chu kì trước. Sự lặp lại tính chất phi kim của các nguyên tô' ở chu kì sau so với chu kì trước. c. Sự lặp lại cấu hình electron lớp ngoài cùng của nguyên tử các nguyên tô' ở chu kì sau so với chu kì trước (ở ba chu kì đầu). D. Sự lặp lại tính chất hoá học của các nguyên tô' ở chu kì sau so với chu kì trước. Chọn đáp án đúng. Những nguyên tô' thuộc nhóm A nào là các nguyên tô' s, nguyên tô' p ? Sộ' electron thuộc lớp ngoài cùng trong nguyên tử của các nguyên tô' s và p khác nhau thê' nào ? 1s22s22p3;. 1s22s22p Một nguyên tô' ở chu kì 3, nhóm VIA trong bảng tuần hoàn các nguyên tô' hoá học. Hỏi: Nguyên tử của nguyên tô' đó có bao nhiêu electron ở lớp electron ngoài cùng ? Các electron ngoài cùng nằm ở lớp electron thứ mấy ? Viết cấu hình electron nguyên tử của nguyên tô' trên. Một sô' nguyên tô' có cấu hình electron của nguyên tử như sau : 1s22s22p4 ; 1s22s22p63s23p1 ; Hãy xác định sô' electron hoá trị của từng nguyên tử. Hãy xác định vị trí của chúng (chu kì, nhóm) trong bảng tuần hoàn các nguyên tô' hoá học. 3s23p Những nguyên tô' nào đứng cuối các chu kì ? cấu hình electron của nguyên tử của các nguyên tô' đó có đặc điểm chung gì ? . Những nguyên tô' nào đứng đầu các chu kì ? cấu hình electron nguyên tử của các nguyên tô' đó có đặc điểm chung gì ?