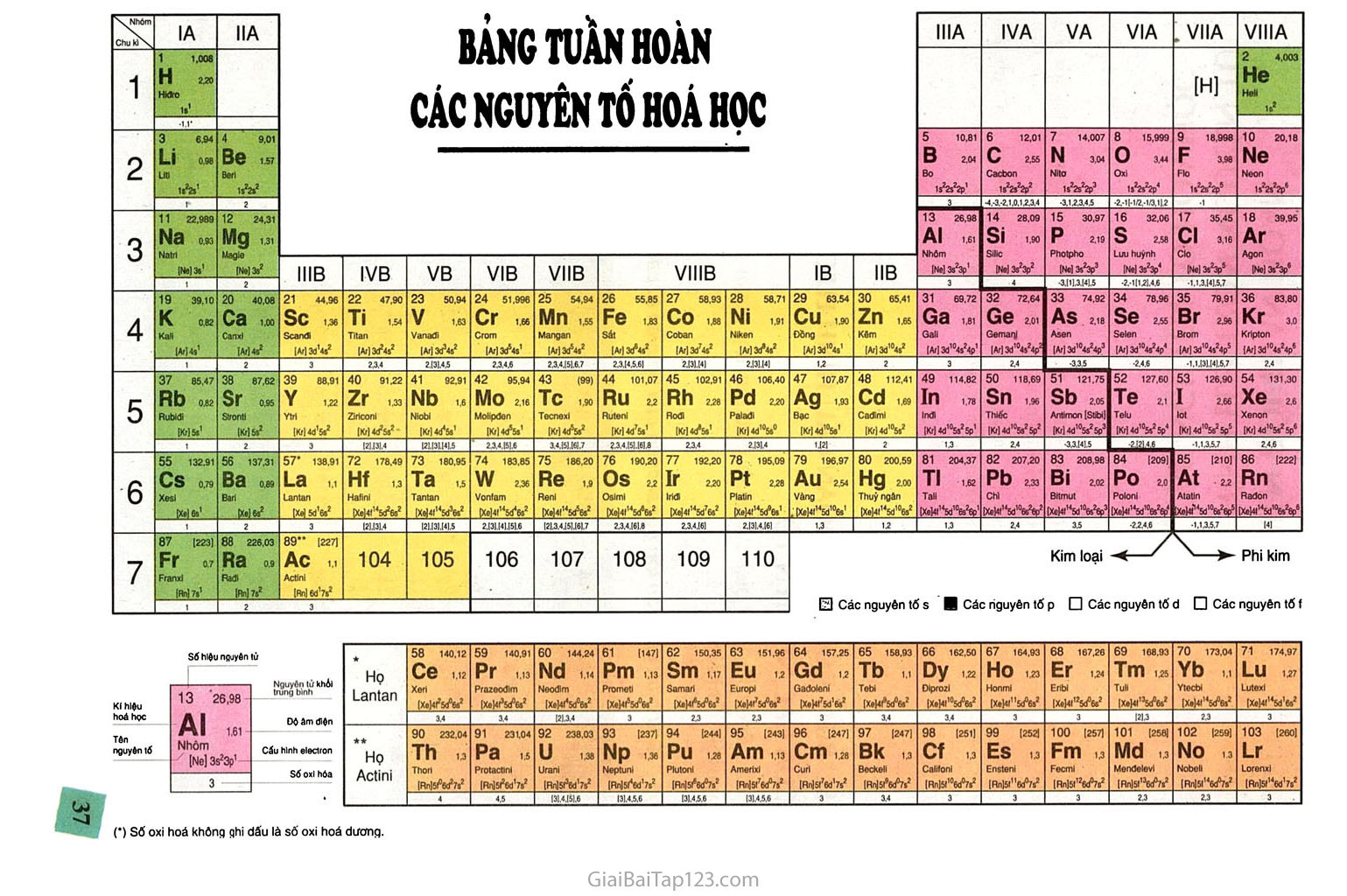
SGK Hóa Học 10 - Tư liệu. Đôi nét về Đi - mi - tri I - va - nô - vich Men - đê - lê - ép và định luật tuần hoàn các nguyên tố hóa học - Bảng tuần hoàn các nguyên tố hóa học
Tư liệu ĐÔI NÉT VỀ ĐI-MI-TRI l-VA-NO-VÍCH MEN-ĐÊ-LÊ-ÉP VÀ ĐỊNH LUẬT TUẦN HOÀN - BẢNG TUẪN hoàn CÁC NGUYÊN TÓ HOÁ HỌC
Đi-mi-tri l-va-no-vích Men-đê-lê-ép sinh ngày 27 tháng 1 năm 1834 ở thành phố To-bon (Tobonxk), trong một gia đình CÓ.17 người con, bố là hiệu trướng Trường Trung học To-bon. Sau khi tốt nghiệp Trường Trung học To-bon, ông vào học tại Trường Đại học Sư phạm Pê-téc-bua và năm 1855, khi tốt nghiệp, ông đã được nhận huy chương vàng. Trong hai năm 1859, 1860 Men-đê-lê-ép làm việc ở Đức. Sau đó, ông trở về nước Nga và được bố nhiệm là giáo sư cúa Trường Đại học Kĩ thuật Pê-téc-bua. Hai năm sau, ông được bố nhiệm là giáo sưcúa Trường Đại học Tống hợp Pê-téc-bua. Sau 33 năm nghiên cứu khoa học và giáng dạy, năm 1892 Men-đê-lê-ép được bố nhiệm làm Giám đốc Khoa học bảo tồn của Trạm Cân đo mẫu. Năm 1893, trạm này đối thành Viện Nghiên cứu khoạ học đo lường mang tên Men-đê-lê-ép.
Kết quả hoạt động sáng tạo vĩ đại nhất của Men-đê-lê-ép là sự phát minh ra định luật tuần hoàn.các nguyên tố năm 1869, lúc đó ông mới 35 tuổi. Ngoài ra, ông còn có nhiều công trình khác có gịá trị như : các nghiên cứu về trọng lượng riêng của dung dịch nước, dung dịch của rượu - nước và khái niệm về dung dịch. Những công trình nghiên cứu _cúa Men-đê-lê-ép về dung dịch là phần quan trọng của thuyết dung dịch hiện đại.
Cuốn "Cơ sớ hoá học" là công trình xuất sắc của Men-đê-lê-ép, trong đó lạn đầu tiên toàn bộ hoá học vô cơ được trình bày theo quan điếm của định luật tuần hoàn. Cuốn sách đã được tái bản rất nhiều lần.
Kết hợp một cách chặt- chê lí thuyết với thực tế, Men-đê-lê-ép luôn luôn quan tâm đến sự phát triển công nghiệp cúa đất nước Nga.
Bảng tuần hoàn các nguyên tố có ảnh hưởng lớn đến sự phát triển cúa' hoậ học. Nó không những là sự phân loại tự nhiên đầu tiên các nguyên tố hoá học, cho biết các nguyên tố có mối liên hệ chặt chẽ và hệ thống, mà còn định hướng cho việc nghiên cứu tiếp tục các nguyên tố mới.
Ngày nay, định luật.tuần hoàn vẫn còn là sợi chỉ dẫn đường và là lí thuyết chú đạo của hoá học. Trên cơ sớ đó, trong những năm gần đây các nguyên tố sau urani đã được điều chế nhân tạo và được xếp sau urani trong bảng tuần hoàn. Một trong các nguyên tố đó là nguyên tố 101 đã được điều chế lần đầu tiên năm 1955 và được đặt tên là menđelevi để tỏ lòng kính trọng nhà bác họe Nga vĩ đại.
Việc phát minh ra định luật tuần hoàn và báng tuần hoàn các nguyên tố hoá học có giá trị to lớn không những đối với hoá học, mà cá đối với triết học.
Thuyết cấu tạo nguyên tứ ở thế kí XX đã soi sáng vào định luật tuần hoàn và báng tuần hoàn các nguyên tố, tìm ra nhiều điều mới mẻ sâu sắc hơn. Những lời tiên tri của Men-đê-lê-ép "Định luật tuần hoàn sẽ không bị đe doạ phá vỡ, mà chí có sự bố sung và phát triển" 'đã có những bằng chứng tuyệt vời.
\NhOm
ChuldK
IA
IIA
nẲvn TlĩìullAÀV
IIIA
IVA
VA
VIA
. VIIA
VIIIA
1
1 1.008
H 2,20
1»’
PÁP vr.ỉiYÍM Tố UAÁ unp
[H]
2 4,003
He
HeH
n2
•I.r
2
3 6,94
Li 0.98
un
4 9.01
BG 1.57 Bert
n^2
•
5 10,81
B 2.04
Bo
6 12,01
c 2,55 Cacbon
«w
7 14.007
N 3,04
Nito
1.W
8 15,999
0 3,44
Oxi
n^v
9 18,998
F 3,98
Flo
nW
10 20,18
Ne
Neon
n^W
1*
2
3
-4.-3,-2.1,0,15,3.4
•3.15,3.4,5
•2.-1I-1/2,-1/3,11,2
•1
3
11 22,989
Na 0.93
12 24,31
Mg 1,31 Magie
IN.ias’
13 26,98
AI 1,81
14 28,09
Si 1,90 Slllc
(Ne]3s23p2
15 30,97
p 2,19
Photpho
[Ne] SsV
16 32,06
s 2,58 Lưu huỳnh
[Ne] 3s V
17 35,45
Cl 3,16
18 39,95
Ar
IM341
IIIB
IVB
VB
VIB
VIIB
VIIIB
IB
IIB
[Ne] SsV
INelasV
1
2
3
4
•3.111.3,(4)3
•2.-1I151.4.6
•1.1.3.(413.7
4
19 39,10
K 0,82
KaH
20 40,08
Ca 1,00
Canxl
[Ar]4s2
21 44,96
Sc 1,36 Scanđi
lArl3d’4»2
22 47,90
Ti 1,54
Titan
[Ar]3d24s2
23 50,94
V 1,53
Vanađi
[Ar]3d34í2
24 51,996
Cr 1,66
Crom
|Arl3đ54s’
25 54,94
Mn u,
Mangan
[Ar]3d54s2
26 55,85
FG 1,83 Sát
[Aí]3d84s2
27 58,93
Co 1.88
Coban
[Ar]3d74s2
28 58,71
Nl 1,91 Niken
[Ar]3d84í2
29 63.54
Cu 1.90
Đòng
lArlSd”*,1
30 65,41
Zn 1.65
Kẽm
[Ar]3d104a2
31 69,72
Ga 1,81
Gali
[ Ar) 3d104s24p’
32 72,64
Ge 2,01
Gemaql
[ArlM'Vip7
33 74.92
As 2,18
Asen
34 78.96
Se 2.55
Selen
[Ar]3d,04s24p4
35 79,91
Br 2,96
Brom
[Ar]3d’°4s24p5
36 83,80
Kr 3.0
Kripton [Af] 3d’°4s24p6
1
2
3
2,3,4
2.I3I.4.5
2.3,4.6
25,4,(51,6.7
2.3.14,5,6)
2,(31,141
2.131,(41
1,2
2
3
2,4
•3,3,5
•2,4,6
•1,1.(3),(4),5,7
2,4
5
37 85,47
Rb 0,82
Rublđi
lKrlS«’
38 87,62
Sr 0,95 Strontt
IKTỈ5S2
39 88,91
Y ,22
Ylri
lKr)4d’5«2
40 91,22
Zr 1,33 Zlriconi
(Kfj4d2Ss2
41 92.91
Nb 1.8
Nlobl
iKrl^Ss’
42 95,94
Mo 2,16
Mollpdon
|K/]4<J55s’
43 (99
Tc 1.9C Tecnexl
[Kr|4ds5e2
44 101,07
Ru 25
Rutenl
IK,|4475s'
45 102,91
Rh 2,28
Rod
[Kr]4dí5e’
46 106,40
Pd 2,20
Palađi
[Kf]4d,05»°
47 107.87
Ag 1.93 Bạc
|K.|«,05j'
48 112,41
Cd 1,69 Cadmi
IKrlM’W
49 114,82
Ind
[Kr]4d,Q5s25p’
50 118,69
Sn 1.98
Thiếc
[Krj4d105s25p2
51 121,75
Sb 2,05 Antimon [Stibi] [Kr]4d105s25p3
52 127,60
Te 2.1
Telu
]M4d,05s!Se'
53 126,90
1 2,66
lot
[Kr]4d'°5s25p5
54 131,30
Xe 2.6
Xenon
(Kd4d’°5e?5p‘
1
2
3
121.131,4
I21.I3I.I4IA
2.3.4,151,6
3.4.I51.I6I.7
2.3,4,(51.161,8
25.4
2.I31.4
1J21
2
15
2.4
•3.3.141.5
-2J21.4.6
•1.1.33.7
2.4.6
6
55 132.91
Cs 0.79 Xesl
M.fe1
56 137,31
Ba 0.89 Bari
57* 138,91
La
Lantan [Xe] 5d’6s2
72 178,49
Hf 1.3
Hafini
[Xe]4l145d26s2
73 180,95
Ta 1.5
Tantan
IXe|4l'*5dW
74 183.85
w 333 Vonlam [Xe)4lu5d46s2
75 186.2C
Rg 1.9 Rent
IXele'^Bs’
76 190,20
Os 2.2
Oslml
[Xo]4(,45d86s2
77 192,20
Ir 2,20
Irid
[Xe]4f145d76s2
78 195,09
Pt 2,28
Platin
[XejAf^S^es’
79 196,97
Au 2,54 Vàng
; IxnMi'W
80 200,59
Hg 2,00
Thuỳ ngân IXoM^ãV
81 204,37
TI 1,82
Tall
[Xekl’WW
82 207,20
Pb 2.33 Chl
[XekWfcW
83 208,98
Bi 2,02
Bltmut
IXsW'Sd'W
84 [209]
Po 2,0
Poloni
[Xe|4ÍWaí
85 [210]
At 33
Atatln
XerfWW
86 [222]
Rn
Radon
XeW'WosV
1
2
3
121.131.4
121.131.141,5
2,131,(41,(51,6
I21.3.4.151.I8I.7
2.3.4.I61.8
2,3,4,16]
2.I3I.4.I6I
1,3
15
1.3
2.4
3.5
•25.4.6
■1,1.33,7
141
7
87 1223]
Fr 0.7
Franxl
IM 7.'
88 226,03
Ra 0.9 Radi
|Rn]7s2
89** [227]
Ac 1.1
Actinl
lRn]6d17s2
104
105
106
107
108
109
110
Kim loại
Phi kim
1
2 3
□ Các nguyên tố
s □ Các nguyên tố p l_| Các nguyên tố d LJ Các nguyên tố f
SỐ hiệu nguyên lử
Nguyôn lừ khổl trung binh
Ki hiệu hoá học
AI 161
Độ âm điện
Tồn
nguyên lố
Nhôm (Ne) 3s23p1
cấu hlnh electron
SỐ oxl hóa
3
58 140,12
59 140,91
60 144,24
61 [147]
62 150,35
63 151,96
64 157.25
65 158,93
66 162,50
67 164,93
68 167,26
69 168,93
70 173,04
71 174,97
Họ
Ce 1,12
Pr 1,13
Nd 1,14
Pm 1.13
Sm 1,17
Eu ,2
Gd ,2
Tb ,,
Dy ,22
Ho 1,23
Er 1.24
Tm 1.23
Yb
Lu 157
Lantan
Xert
Prazeodlm
Neodm
Prometl
Samari
Europl
Gađoleni
Tebl
Dlprozl
Honml
Eriw
Tull
Ytecbi
Lutexi
[Xeler’sa0^
(x.pPiA,7
[Xe^SdW
[XeMfafte2
[XeMlWfc2
|X4|4i7sAi!
ÍXel4,75d'es2
|Xe]4l®5dW
lx.Hl'Vos1
[Xe]4l”5d°6s2
[X.l4l'V8e!
[XeỊ4l,35d°6s2
lX.Hl'Vo,7
IXelel’^’u2
3.4
3.4
121.3.4
3
25
25
3
3,4
3.4
3
3
1215
25
3
90 232,04
91 231,04
92 238,03
93 1237]
94 [244]
95 [243]
96 [2471
97 [247]
98 [251]
99 [2521
100 [257]
101 12581
102 I259]
103 [260]
Họ
Th 13
Pa 1,5
U ,38
Np ,33
Pu 123
Am 1,13
Cm ,28
Bk 13
Cf 13
Es 1.3
Fm ,3
Md 13
No 1.3
Lr
Thon
Prolactlnl
Uranl
Nepĩuni
Plutonl
Amerlxl
Curl
Beckell
Calilonl
Enstenl
Fecml
Menđelevl
Nobell
Lorenxi
[RnJ^eAi2
[Rn^edV
[Rn]5rW7s2
[RnlS^BdW
[Rn]5(*6d°7s2
IRn]5178dV
[Rn]5l76d’7s2
[Rn]5l96d°7s2
[Rn)5l,06d°7s2
[AnI5l''6d°7s2
[Rn]5l’26d°7s2
[Rn]5('36d°7s2
[Rn]5ll46d°7s2
[Rn]5('46d’7e2
4
4,5
131.4,151,6
131.4,5,6
(31.4.5,6
131,4.5,6
3
3,4
3
3
3
2,3
2,3
3
(*) Sô' oxi hoá không ghi dấu là sổ oxi hoá dương.