Giải bài tập Hóa 9 Bài 3: Tính chất hóa học của axit
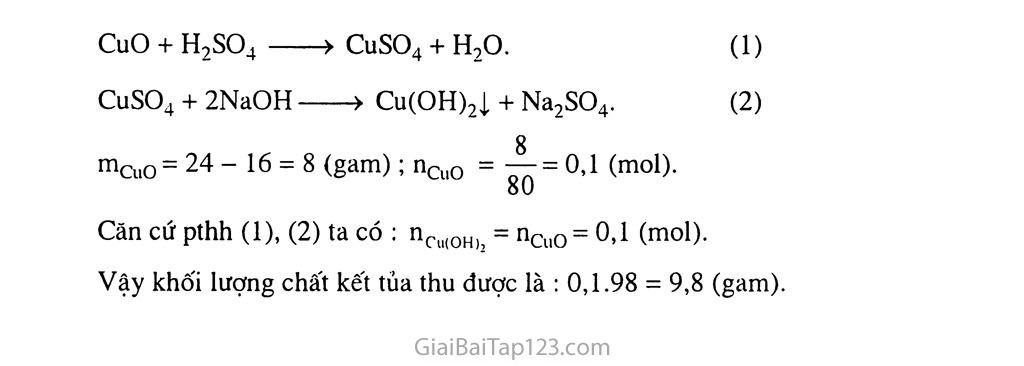
Bài 3 TÍNH CHẤT HOÁ HỌC CỦA AXIT A. KIẾN THỨC TRỌNG TÂM Tính chất hoá học của axit : tác dụng với quỳ tím, với kim loại, với bazơ và oxit bazơ. Quan sát thí nghiệm và rút ra kết luận về tính chất hoá học của axit nói chung. Viết các pthh chứng minh tính chất của axit. . Nhận biết được dung dịch axit và dung dịch muối của axit. Tính nồng độ hoặc khối lượng dung dịch axit trong phản ứng. Bài 2. a) Mg + HC1 b) CuO + HC1 HƯỚNG DẪN GIẢI BÀI TẬP TRONG SGK Fe(OH)3 + HC1 hoặc Fe2O3 + HC1 Mg + HC1 hoặc A12O3 + HC1 Bài 4. a) Phương pháp hoá học : Ngâm hỗn hợp bột Cu và Fe trong dung dịch HC1 dư. Phản ứng xong, lọc lấy chất rắn, rửa nhiều lần trên giấy lọc. Làm khô chất rắn, thu được bột Cu.'Cân, giả sử được 6 gam. Suy ra trong hỗn hợp có 60% Cu và 40% Fe. Viết PTHH. b) Phương pháp vật lí: Dùng thanh nam châm (sau khi đã bọc đầu nam châm bằng mảnh nilon nhỏ, mỏng) chà nhiều lần, ta cũng thu được 4 gam bột Fe. c. BÀI TẬP BỔ SƯNG VÀ HƯỚNG DẪN giải Bài tập Bài 1. Dãy kim loại nào sau đây tác dụng được với dung dịch axit clohiđric ? A. Fe, Mg, Ni, Zn, Au. B. Mg, Cu, Pb, Sn, Fe c. Mg, Al, Ag, Na. D. Zn, Mg, Al, Ca. Bài 2. Cho 5,6 gam Fe tác dụng với 300 ml dung dịch HC1 1 M. Sau khi phản ứng xảy ra hoàn toàn thu được số lít khí H2 (đktc) là A. 2,24 lít B. 3,36 lít c. 4,48 lít D. 1,12 lít Bài 3. Nêu hiện tượng và viết pthh xảy ra (nếu có) giữa các chất sau : Dung dịch HC1 và CuO. Dung dịch H2SO4 và dung dịch BaCl2. Dung dịch HNO3 đặc, nóng và Fe. Bài 4. Cho các hoá chất sau : CuO, Cu, Mg, CO2, dung dịch NaOH, dung dịch Baơ2. Những hoá chất nào tác dụng với dung dịch HC1 ? Những hoá chất nào tác dụng với dung dịch H2SO4(loSng) ? Những hoá chất nào tác dụng với dung dịch H2SO4(đặC) ? Viết các pthh xảy ra. Bài 5. Bằng phương pháp hoá học, hãy phân biệt các hoá chất riêng biệt sau : dung dịch NaCl, dung dịch K2SO4, dung dịch H2SO4(loỉng). dung dịch Na2SO4, dung dịch H2SO4(ioãng), dung dịch H2SO4(đặc). Bài 6. Cho hỗn hợp 24 gam gồm CuO và Cu tác dụng với lượng dư dung dịch H2SO4 im, sau khi phản ứng xảy ra hoàn toàn, thu được dung dịch A và 16 gam chất rắn. Tính % khối lượng các chất trong hỗn hợp ban đầu. Cho dung dịch A tác dụng với lượng dư dung dịch NaOH thì thu được bao nhiêu gam chất kết tủa ? II. Hướng dẫn giải Bài 1. D Bài 2. A Bài 3. a) CuO màu đen tan và dung dịch chuyển màu xanh lam CuClợ: CuO + 2HC1 > CuCl2 + H2O Có kết tủa trắng BaSO4 : BaCl2 + H2SO4 > BaSO4 ị + 2HC1 Fe bị hoà tan và có khí màu nâu đỏ thoát ra : Fe + 6HNO3 > Fe(NO3)3 + 3NO2 T + 3H2O Bài 4. a) CuO, Mg, NaOH ; b) CuO, Mg, NaOH, BaCl2 c) CuO, Mg, Cu, NaOH, BaClọ Bài 5. a) Dung dịch làm quỳ tím hoá đỏ là dung dịch HC1 và dung dịch H2SO4 Dùng BaCl2 nhận biết được H2SO4 vì có kết tủa trắng xuất hiện : H2SO4 + BaCl2 > BaSO4ị+ 2HC1. Hai dung dịch còn lại ta tiếp tục dùng BaCl2. Dung dịch nào có kết tủa trắng xuất hiện là K2SO4, dung dịch còn lại là NaCl. K2SO4 + BaCl2 > BaSO4ị+ 2KC1. b) Cho Cu vào các mẫu dung dịch : Cu tan và dung dịch sủi bọt khí là dung dịch HỌSO4 đặc. Dùng quỳ tím cho vào 2 dung dịch còn lại : Quỳ tím chuyển màu đỏ là dung dịch H2SO4. Dung dịch còn lại là Na,SO4. Cu + 2H2SO4 (dặc) —CuSO4 + SO2T + 2H2O. Bài 6. a) Chất rắn không tan là Cu có khối lượng là 16 gam. %Cu = —-L°°.” ~ 66.67%. ; %CuO = 100% - 66,67% = 33,33%. 24 b) Pthh : CuO + H9SO4 >CuSO4 + H2O. (1) CuSO4 + 2NaOH > Cu(OH)2ị + Na2SO4. (2) mcuo= 24 -16 = 8 (gam); nCuO = A = 0,1 (mol). oU Cãn cứ pthh (1), (2) ta có : nCu(0H)j = nCuO= 0,1 (mol). Vậy khối lượng chất kết tủa thu được là : 0,1.98 = 9,8 (gam).