Giải bài tập Hóa 9 Bài 5: Luyện tập: Tính chất hóa học của oxit và axit
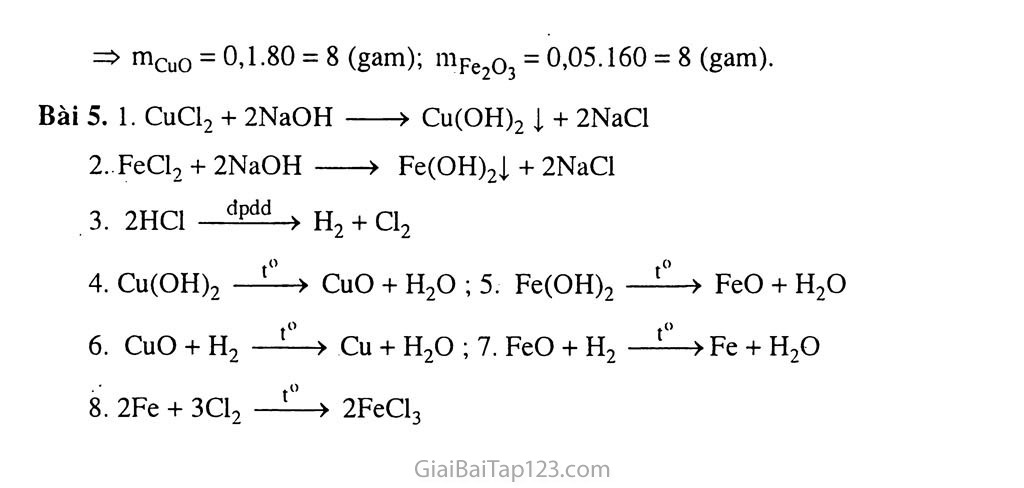
Bài 5. Luyện Tập TÍNH CHẤT HOÁ HỌC CỦA OXIT VÀ AXIT KIẾN THỨC TRỌNG TÂM Tính chất hoá học của oxit bazơ, oxit axit và mối quan hệ giữa oxit bazơ và oxit axit. Tính chất hoá học của axit. Dẫn ra những phản ứng hoá học minh họa cho tính chất của những hợp chất trên bằng những chất cụ thể, như CaO, so2, HC1, H2SO4. Vận dụng những kiến thức về oxit, axit để làm bài tập. HƯỚNG DẪN GIẢI BÀI TẬP TRONG SGK Bài 1. a) Những oxit tác dụng với nước : so2, Na2O, co2. Những oxit tác dụng với axit clohiđric : CuO, Na2O. Những oxit tác dụng với natri hiđroxit : so2, co2. Bài 2. a) Cả 5 oxit đã cho. Những oxit là : CuO, co2 (phân huỷ CuCO3 hoặc Cu(OH)2 được CuO ; phân huỷ CaCO3 được co2). Bài 3. Cho hỗn hợp khí co, co2, SO2 lội chậm qua dung dịch Ca(OH)2. co2 và so2 bị giữ lại trong dung dịch Ca(OH)2 vì tạo ra chất không tan là CaCO3 và CaSO3. Bài 4. Viết các phương trình hóa học của phản ứng giữa H7SO4 với CuO và H2SO4 đặc với Cu. Dựa vào các phương trình hóa học, ta biện luận muốrì thu được n mol CuSO4 cần bao nhiêu mol H2SO4. Bài 5. Hướng dần một số phản ứng hoá học : (3) so2 +NaOH (dd) (6) SO2 + H2O (8) Na2SO3 + H2SO4 loãng c. BÀI TẬP BỔ SƯNG VÀ HƯỚNG DẪN GIẢI Bài tập Bài 1. Trộn 100 ml dung dịch NaOH 1 M với 200 ml dung dịch HC1 0,75 M thu được dung dịch A. Cho quỳ tím vào đung dịch A, quỳ tím chuyển màu A. đỏ B. xanh c. không đổi màu D. xanh sau đó chuyển sang màu đỏ Bài 2. Hấp thụ hoàn toàn 3,36 lít co2 (đktc) bằng dung dịch có hòa tan 8 gam NaOH và 3,7 gam Ca(OH)2. Khối lượng chất kết tủa thu được là A. 15 gam B. 5 gam c. 10 gam D. 20 gam Bài 3. Cho m gam sắt tác dụng vừa đủ với 500 ml dung dịch HC1 thu được 6,72 lít khí (đktc). Nồng độ của của dung dịch muối thu được là A. 0,6 M B. 0,12 M c. 0,3 M D. 0,15 M Bài 4. Hòa tan hoàn toàn 16 gam hỗn hợp CuO và Fe2O3 bằng dung dịch HC1 dư. Cô cạn dung dịch thu được 29,75 gam muối. Viết các phương trình hóa học. Tính khối lượng mỗi oxit trong hỗn hợp. Bài 5. Cho các dung dịch : CuCl2, FeCl2, HC1 và NaOH. Viết phương trình hóa học điều chế các chất: H2, Cl2, FeO, CuO, Fe, Cu, FeCl3. Hướng dẫn giải Bài 1. A Bài 2. B Bài 3. A Bài 4. Phương trình hóa học : CuO 2HC1 > CuCl2 + H2O X X Fe2O3 + 6HC1 > 2FeCl3 + 3H2O y 2y Gọi số mol của CuO và Fe?o3 lần lượt là X, y mol. Theo các phương trình hóa học và theo bài ra ta có : 80x + 160y = 16 135x + 162,5.2y =29,75 Giải hệ trên ta có : X = 0,1; y = 0,05. . => mCuO = 0,1.80 = 8 (gam); mFe203 = 0,05.160 = 8 (gam). Bài 5. 1. CuCl2 + 2NaOH > Cu(OH)2 ị + 2NaCl FeCl, + 2NaOH > Fe(OH)2ị + 2NaCl 2HC1 h2 + Cl2 Cu(OH)2 —CuO + H2O ; 5. Fe(OH)2 —FeO + H2O 6. CuO + H2 —Cu + H2O ; 7. FeO + H2 —^->Fe + H2O 8. 2Fe + 3C12 2FeCl3