Giải bài tập Hóa 9 Bài 56: Ôn tập cuối năm
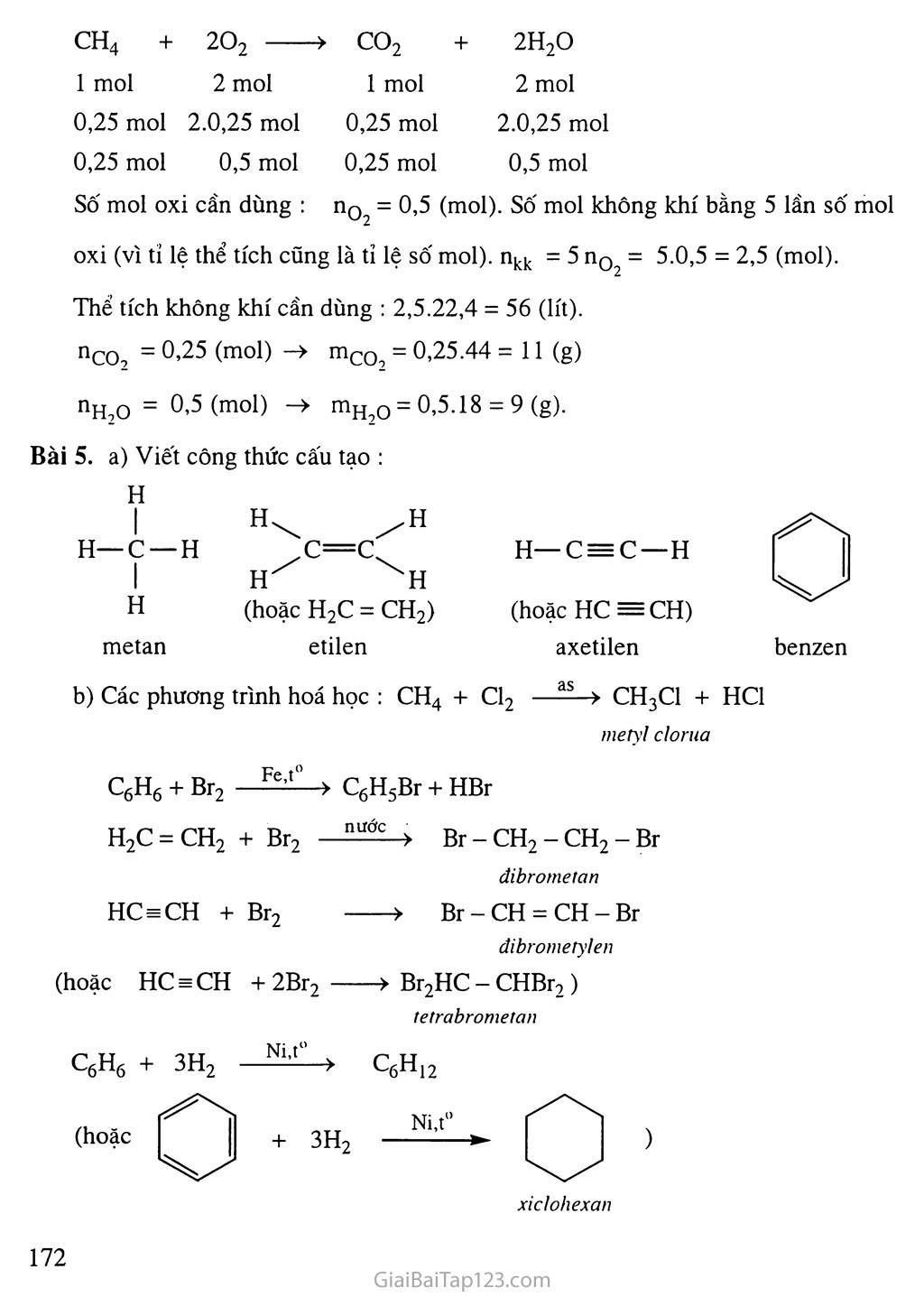
ÔN TẬP CUỐI NĂM. PHẦN 1 : HOÁ VÔ Cơ KIẾN THỨC TRỌNG TÂM HS thiết lập được mối quan hệ giữa các chất vô cơ : kim loại, phi kim, oxit, axit, bazơ, muối được biểu diễn bởi sơ đồ trong bài học. Biết thiết lập mối quan hệ giữa các chất vô cơ dựa trên tính chất và các phương pháp điều chế chúng. Biết chọn chất cụ thể để chứng minh cho mối quan hệ được thiết lập. Vận dụng tính chất của các chất vô cơ đã học để viết được các PTHH biểu diễn mối quan hệ giữa các chất. HƯỚNG DẪN GIẢI BÀI TẬP TRONG SGK Bài 1. Có thể nhận biết như sau : Cho viên kẽm vào cả 2 ống nghiệm đựng 2 dung dịch riêng biệt, nếu sinh ra bọt khí không màu thì đó là dung dịch H2SO4, nếu không có hiện tượng gì là dung dịch Na2SO4. Cho đinh sắt vào cả 2 ống nghiệm đựng từng dung dịch riêng biệt, nếu sinh ra bọt khí không màu thì đó là dung dịch HC1, nếu không có hiện tượng gì là dung dịch FeCl2. Lấy một ít (bằng hạt đậu) Na2CO3 và CaCO3 vào 2 ống nghiệm riêng biệt đựng dung dịch H2SO4 loãng, dư. Nếu có khí bay ra, chất rắn tan hết, đó là Na2CO3. Nếu có khí bay ra, đồng thời có kết tủa tạo thành, đó là CaCO3. Bài 2. Có thể có dãy chuyển đổi sau : ✓ FeCl3 > Fe(OH)3 > Fe2O3 > Fe > FeCl2 Bài 3. Có thể điều chế bằng cách : Điện phân dung dịch NaCl bão hoà có màng ngăn : 2NaCl + 2H2O ■ .di^n Phãn^ 2NaOH + H2 + Cl2 2 m.n 2 2 Điều chê' theo dãy chuyển đổi: NaCl > HC1 > Cl2. I Bài 4. Có thể nhận biết như sau : Dùng quỳ tím ẩm nhận ra được : + Khí clo (làm mất màu giấy quỳ ẩm). + Khí co2 (làm đỏ giấy quỳ ẩm). Hai khí còn lại đem đốt cháy, làm lạnh sản phẩm nếu thấy có H2O ngưng tụ, thì khí đó là H2, khí còn lại là co. 1 mol 6 mol Chất rắn màu đỏ là Cu có số mol là : 3,2 : 64 = 0,05 (mol). Số mol Fe tham gia phản ứng (1): 0,05 mol. %mFe = 0,05 * 56 X 100% « 58,33% he 4,8 %mFe203 = 100% - 58,33% « 41,67% Hoặc : mFe Q = 4,8 - 0,05 X 56 = 2 (gam). %mFe„n„ = -Ặ-x 100% « 41,67% Fe2°3 4,8 %mFe ss 58,33%. c. BÀI TẬP BỔ SƯNG VÀ HƯỚNG DẪN giải I. Bài tập Bài 1. Oxit nào sau đây tác dụng với nước tạo axit ? A. so3. B. Na2O. c. co2. D. so3 và co2. Bài 2. Axit không có tính chất đặc trưng là A. làm đỏ quỳ tím. B. tác dụng với bazơ. c. tác dụng với oxit bazo. D. tác dụng với muối của axit mạnh. Bài 3. Thuốc thử dùng để phân biệt hai dung dịch HC1 và H2SO4 loãng là A. Quỳ tím. B. Cu. c. BaCl2. D. KOH. Bài 4. Trong các lọ không màu đựng riêng rẽ, dung dịch có thể dùng HC1 để phân biệt là A. NaOH ; Na2CO3 ; AgNO3. B. Na2CO3; Na2SO4 ; KNO3. c. KOH ; KHCO3 ; K2CO3. D. Ca(OH)2 ; Ca(HCO3)2 ; NaOH. Bài 5. Người ta sử dụng AI làm dây cáp dẫn điện nhiều hơn so với Cu, mặc dù Cu dẫn điện tốt hơn Al, là do A. AI là một kim loại dẫn điện tốt. B. AI bền, nhẹ hơn đồng, c. AI rẻ tiền hơn đồng. D. tất cả các nguyên nhân trên. Bài 6. Phản ứng nào sau đây không xảy ra ? A. CuO + HC1 -> B. Cu + H2SO4 loãng -> c. Fe + HC1 -4- D. FeO + HC1 -> Bài 7. Đốt hỗn hợp 8,4 gam sắt và 3,2 gam lưu huỳnh trong bình kín đến khi kết thúc phản ứng. Sản phẩm thu được cho phản ứng với dung dịch HC1 dư thì khí thoát ra là A. H2S. B. H2và.H2S. c. H2 và so2. D. H2. Bài 8. Dẫn 1,12 lít hỗn hợp khí COọ và so2 có tỉ khối so với hiđro là 27 đi qua dung dịch canxi hiđroxit dư. Viết các phương trình hoá học. Tính khối lượng mỗi muối. Tính thành phần % theo thể tích của hỗn hợp khí ban đầu. Bài 9. Cho thanh sắt nặng 15,0 gam vào 500 ml dung dịch AgNO3 O,1M. Sau khi phản ứng hoàn toàn lấy thanh sắt ra, sấy khô cân nặng m gam và thu được dung dịch A. Tính m. Cho toàn bộ dung dịch A tác dụng với dung dịch NaOH dư, lọc nung kết tủa ngoài không khí đến khối lượng không đổi thu được bao nhiêu gam chất rắn ? Bài 10. Cho 8,7 gam MnO2 tác dụng với HC1 đặc, dư thu được một lượng khí X. Khí X hấp thụ hoàn toàn vào 500 ml dung dịch NaOH 0,4M ở nhiệt độ thường thu được dung dịch A. Xác định các chất có trong dung dịch A. II. Hưóng dẫn giải Bài 1. D ; Bài 2. D ; Bài 3. c Bài 4. A ; Bài 5. D ; Bài 6. B ; Bài 7. B 1,12 Bài 8. nhh = = 0,05 (mol); Đặt X, y lần lượt là số mol so2 và co2. Khối lượng mol trung bình của hỗn hợp = 27.2 = 54 Phương trình hoá học : so2 + Ca(OH)2-> CaSO3 + H2O — 64x + 44y 51 X mol X mol co2 + Ca(OH)2—> CaCO3 + H2O y mol y mol X + y = 0,05 (II) Từ (I) và (II) => Giải hệ phương trình bậc nhất ta được X = 0,025 mol; y = 0,025 mol. Khối lượng các chất sau phản ứng : mCaCQ3 = 0,025.100 = 2,5 (gam); mCaSO3 = 0,025.(40 + 32 + 48) = 3,0 (gam). Thành phần % theo thể tích của hỗn hợp khí ban đầu. Số mol của co2 = số mol SOọ = 0,025 mol. %so2 = %co2 = 50%. Bài 9. a) Phương trình hoá học : Fe + 2AgNO3 -> Fe(NO3)2 + 2Ag nAgNO3 = 0,5.0,1 = 0,05 (mol) 2 mol AgNO3 phản ứng khối lượng thanh sắt tăng : 2.108 - 56 = 160 (gam) 0,05 mol y-— = 4 (gam) Khối lượng thanh sắt sau phản ứng là:m=15 + 4=19 (gam). Dung dịch A thu được nFe(NQ3b = 0,05 : 2 = 0,025 (mol) Fe(NO3)2 + 2NaOH -> Fe(OH)2ị + 2NaNO3 4Fe(OH)2 + 02 -> 2Fe2O3 + 4H2O => nFe2o3 - °’025 : 2 = 0,0125 (mol); mFe203 = 0,0125.160 = 2,0 (gam). Bài 10. MnO2 + 4HC1 -4- MnCl2 + Cl2t + 2H2O (1) Cl2 + 2NaOH -> NaCl + NaClO + H20 (2) Ta có : nCị2 = nMnC!2 = ly = 0,1 (mol); nNa0H = 0,5.0,4 = 0,2 (mol) = 2 nC!2 Vậy theo phương trình (2), Clọ phản ứng vừa hết với NaOH, dung dịch A gồm NaCl, NaClO và H2O. PHẦN 2 : HOÁ HỮU Cơ KIẾN THỨC TRỌNG TÂM Củng cố lại những kiến thức đã học về các chất hữu cơ. Hình thành mối liên hệ cơ bản giữa các chất. Củng cố các kĩ năng giải bài tập, các kĩ năng vận dụng kiến thức vào thực tế. HƯỚNG DẪN GIẢI BÀI TẬP TRONG SGK Bài 1. Điểm chung : Đều là hiđrocacbon. b) Đều là dẫn xuất của hiđrocacbon. Đều là hợp chất cao phân tử. d) Đều là este. Bài 2. a) Đều là nhiên liệu. b) Đểu là gluxit. Bài 4. Câu đúng là câu e. Bài 5. Phương pháp nhận biết: Thí nghiệm 1 : Dùng dung dịch Ca(OH)2 nhận được khí co2. Thí nghiệm 2 : Dùng dung dịch brom dư nhận được các khí còn lại. Thí nghiệm 1 : Dùng Na2CO3 nhận được axit axetic. Thí nghiệm 2 : Cho tác dụng với Na nhận được rượu etylic. Thí nghiệm 1 : Cho tác dụng với Na2CO3 nhận được axit axetic. Thí nghiệm 2 : Cho tác dụng với AgNO3 trong NH3 dư nhận được glucozo. Bài 6. Công thức phân tử là C2H4O2. Bài 7. Chất A là protein. c. BÀI TẬP BỔ SƯNG VÀ HƯỚNG DAN giai I. Bài tập Bài 1. a) Dãy các chất đều làm mất màu dung dịch brom là : A. CH4, C6Hõ B. C2H4, C2H2 c. ch4, C2H2 D. c6h6, c2h2 b) Dãy các chất đều phản ứng với dung dịch NaOH là : A. CH3OOH,-4-C6HlũO54n- B. CH3COOC2H5, C2H5OH c. CH3COOH, C6H12O6 D. CH3COOH, CH3COOC2H5 Bài 2. Nhóm chất hữu cơ nào sau đây đều có phản ứng thuỷ phân ? Tinh bột, xenlulozo, protein, saccarozo, etyl axetat. Benzen, xenlulozo, protein, saccarozo, rượu etylic. c. Tinh bột, xenlulozo, polietilen, saccarozo, glucozo. D. Tinh bột, xenlulozo, protein, saccarozo, axit axetic. Bài 3. Nhận định nào sau là đúng ? Tơ tằm là xenlulozơ. Tơ nhân tạo như tơ visco, tơ axetat không có nguồn gốc từ xenlulozo. c. Vải cotton và giấy có chung nguồn gốc là xenlulozo. D. Tơ là những polime tự nhiên hay tổng hợp có cấu trúc không gian. Bài 4. a) Tính thể tích không khí cần dùng để đốt cháy 2,8 lít metan (ở điều kiện tiêu chuẩn), biết rằng oxi chiếm 20% thể tích không khí. b) Tính số gam khí cacbonic và nước tạo thành sau phản ứng. Bài 5. a) Viết công thức cấu tạo của metan, etiien, axetilen, benzen. Viết phương trình hoá học của phản ứng và ghi điều kiện (nếu có) để chứng minh rằng : - Metan và benzen đều tham gia phản ứng thế. - Etilen, axetilen và benzen đều tham gia phản ứng cộng. Nguyên nhân nào làm cho benzen có tính chất hoá học khác và giống etilen, axetilen. Bài 6. Làm thế nào phân biệt được : a) Tơ tổng hợp và tơ tằm ; b) Tinh bột và xenlulozơ. Saccarozơ và glucozơ. Bài 7. Ghép ứng dụng ở cột (II) với chất tương ứng ở cột (I) Chất (Ị) ứng dụng (II) A. CH3COOH. 1. Sản xuất giấy B. Chất béo 2. Thực phẩm c. Glucozơ 3. Sản xuất vitamin c D. Tinh bột 4. Sản xuất xà phòng E. Xenlulozơ 5. Sản xuất phẩm nhuộm 6. T ráng-gương 7. Sản xuất vải sợi Bài 8. Thực hiện dãy chuyển hoá sau bằng các phương trình hoá học : Tinh bột ——^Glucozơ—>Rượu etylic—>Axitaxetic —>Etyl axetat Saccarozo Bài 9. Người ta chế biến rượu etylic từ tinh bột. Viết các phương trình hoá học của quá trình chế biến. Tính khối lượng tinh bột (kg) cần dùng để chế biến 1000 lít cồn 90°. Khối lượng riêng rượu etylic 0,8 g/ml, hiệu suất quá trình sản xuất là 80%. II. Hưống dẫn giải Bài 1. B ; Bài 2. A ; Bài 3. c Bài 4. nCH =Ậ^- = 0,25(mol) CH4 22,4 ch4 + 2O2 > co2 + 2H2O 1 mol 2 mol 1 mol 2 mol 0,25 mol 2.0,25 mol 0,25 mol 2.0,25 mol 0,25 mol 0,5 mol 0,25 mol 0,5 mol Số mol oxi cần dùng : nƠ2 = 0,5 (mol). Số mol không khí bằng 5 lần số mol oxi (vì tỉ lệ thể tích cũng là tỉ lệ số mol). nkk = 5 nƠ2 = 5.0,5 = 2,5 (mol). Thể tích không khí cần dùng : 2,5.22,4 = 56 (lít). nco2 - °’25 (mo1) mco2 = 0,25.44 = 11 (g) nH2o = 0,5 (mol) -> mH2Q = 0,5.18 = 9(g). Bài 5. a) Viết công thức cấu tạo : H 1 H—c —H 1 w H H— C = C— H H (hoặc H2C = CH2) (hoặc HC—CH) metan etilen axetilen benzen b) Các phương trình hoá học : CH4 + Cl2 ——> CH3C1 + HC1 metyỉ clorua C6H6 + Br2 ■ Fe/Ĩ -> CgHgBr + HBr H2C = CH2 + Br2 nư Br - CH2 - CH2 - Br dibrometan HC = CH + Br2 > Br-CH = CH-Br đibrometylen (hoặc HC SE CH + 2Br2 > Br2HC - CHBr2 ) tetrabrometan C6H6 + 3H2 Ni,t° . > U6H12 lsji t° (hoặc + 3H2 ’ > ) xiclohexan c) Benzen có cấu tạo đặc biệt : một vòng 6 cạnh đều, chứa 3 liên kết đôi và 3 liên kết đơn xen kẽ nhau, đó là nguyên nhân dẫn đến benzen có tính chất hoá học khác và giống etilen, axetilen. Bài 6. Cách phân biệt : a) Tơ tổng hợp và tơ tằm : Đốt 2 loại tơ, tơ tằm có mùi khét của protein. Tinh bột và xenlulozơ : Dùng iot nhận ra tinh bột : tinh bột từ màu trắng chuyển sang màu xanh. Saccarozơ và glucozơ : Nhận ra glucozơ bằng phản ứng tráng gương. Bài 7. A-5 ; B-2,4 ; C-2,3,6 ; D-2 ; E-1,7 Bài 8. Thực hiện dãy chuyển hoá : -EC6H10O54ir + n H2O —nC6H12O6 C12H22Oh + H2O ———> C6H12O6 + C6H12Oố Glucozơ Fructozơ C6H12O6 men rượu 2C2H5OH+ 2CO2 C2H5OH + 02 mcn81ấm ■> CH3COOH + H2O C2H5OH + CH3COOH <==± CH3COOC2H5 + H2O Bài 9. a) -4C6H10O54n + nH2O nC6H12O6 (1) C6H12O6' > 2C2H5OH + 2CO2 (2) b) Thể tích rượu nguyên chất cần sản xuất : = 900 (lít)- Khối lượng rượu : 900.0,8 = 720 (kg). Theo PTHH (2) khối lượng glucozơ cần dùng là : » 1408,7 m Theo PTHH (1) tính được khối lượng tinh bột cần dùng là: 1267,83 (kg). Vì hiệu suất quá trình đạt 80% nên thực tế khối lượng tinh bột cần dùng là : 1267,83.100 = 1584;79